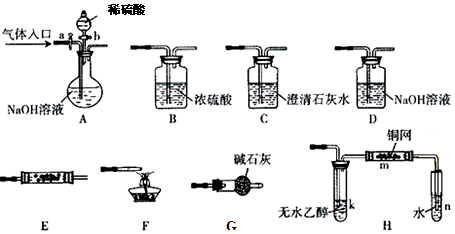
题目内容
关于图中各装置的叙述不正确的是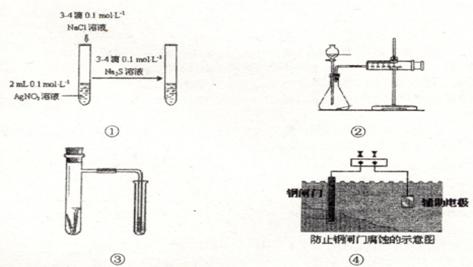
| A.装置①能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
| B.装置②能测量锌与硫酸的反应速率 |
| C.装置③能验证铁的吸氧腐蚀 |
| D.装置④的X电极是负极,则能验证外接电源的阴极保护法 |
A
解析试题分析:A. 装置①中向硝酸银溶液中加入NaCl,由于溶液中c(Cl-)c(Ag+)>Ksp(AgCl),所以会形成AgCl沉淀,但是在溶液中存在沉淀溶解平衡,若再向该溶液中加入Na2S溶液,由于在溶液中c(S2-)c2(Ag+) >Ksp(Ag2S),所以又形成Ag2S沉淀,这样就破坏了AgCl的沉淀溶解平衡,沉淀会又溶解,产生的离子又反应产生Ag2S沉淀,最终沉淀转化为黑色,但是不能验证AgCl和Ag2S溶解度的大小;B. 化学反应速率的快慢可以通过单位时间内产生氢气的体积的多少或产生相同体积的氢气需要时间的多少,因此可以用装置②能测量锌与硫酸的反应速率,正确;C. 若铁发生的是吸氧腐蚀,则装置中的气体压强会减小,水会进入导气管,因此装置③能验证铁的吸氧腐蚀,正确;D. 装置④的X电极是负极,观察钢铁腐蚀的速率比连接电源前腐蚀的快慢,从而能验证外接电源的阴极保护法,正确。
考点:考查实验装置与实验目的的关系的知识。

练习册系列答案
相关题目
实验室制备1,2-二溴乙烷的反应原理如下:
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示: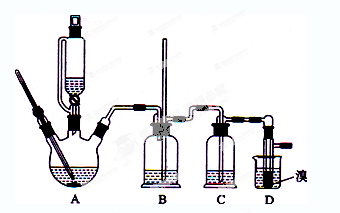
有关数据列表如下:
| | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用 的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
根据下列实验操作和现象所得出的结论不正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向等浓度且较稀的NaCl、KI混合 液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 向溶液x中滴加浓NaOH溶液, 将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
| C | 溴乙烷与NaOH溶液共热后,加入 AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷没有发生水解 |
| D | 将SO2通入溴水中 | 溴水褪色 | SO2具有还原性 |
下列实验方案设计中,可行的是
| A.用萃取的方法可将汽油和煤油进行分离 |
| B.加过量稀盐酸后过滤,可除去混在铜粉中的少量镁粉和铝粉 |
| C.用溶解、过滤的方法可分离硝酸钾和氯化钠固体混合物 |
| D.将混有氢气的氧气通过灼热的氧化铜,以除去其中的氢气 |
已知:Ki1(H2CO3)> Ki1(H2S)。现有以下试剂:盐酸、醋酸、苯酚、碳酸钙、醋酸钠溶液、硫化钠溶液,用下图所示装置进行下列实验,无法达到实验目的的是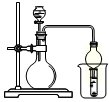
| A.比较醋酸、苯酚、碳酸的酸性 |
| B.比较盐酸、醋酸、碳酸的酸性 |
| C.比较醋酸、氢硫酸、碳酸的酸性 |
| D.比较盐酸、碳酸、氢硫酸的酸性 |
下列实验不能达到预期实验目的的是( )
| 序号 | 实验内容 | 实验目的 |
| A | 向盛有10滴0.1 mol·L-1 AgNO3溶液的试管中滴加0.1 mol·L-1 NaCl溶液,至不再有沉淀生成,再向其中滴加0.1 mol·L-1 Na2S溶液 | 证明AgCl能转化为溶解度更小的Ag2S |
| B | 向2 mL甲苯中加入3滴酸性KMnO4溶液,振荡;向2 mL苯中加入3滴酸性KMnO4溶液,振荡 | 证明与苯环相连的甲基易被氧化 |
| C | 向Na2SiO3溶液中通入CO2 | 证明碳酸的酸性比硅酸强 |
| D | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 | 验证淀粉已水解 |
下列关于各实验装置图的叙述中正确的是( )

| A.装置①:构成锌—铜原电池 |
| B.装置②:除去Cl2中含有的少量HCl |
| C.装置③:验证溴乙烷发生消去反应生成烯烃 |
| D.装置④:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH |