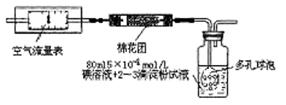
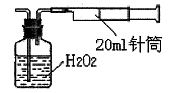
题目内容
下列不能达到实验目的的是
| 序号 | 实验内容 | 实验目的 |
| A | 用石墨电极电解Mg(NO3)2、Cu( NO3)2的混合液 | 比较确定铜和镁的金属活动性强弱 |
| B | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH | 确定碳和硅两元素非金属性强弱 |
| C | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
C
解析试题分析:A、根据金属阳离子在阴极放电的先后顺序可以判断金属活动性强弱,铜离子先放电,金属铜活动性就弱,正确;B、根据“越弱越水解”盐类水解规律,最高价含氧酸的酸性越弱其对应的酸根离子水解程度越大,pH越大,进一步推出其非金属性越弱,正确;C、用pH试纸测定浓度为0.1mol·L-1NaClO,最终试纸漂白,实验达不到目的,错误;D、控制单一变量法,改变浓度,能够达到实验目的,正确。
考点:电解原理、盐的水解原理及化学反应速率的影响因素。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
实验室制备1,2-二溴乙烷的反应原理如下:
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示: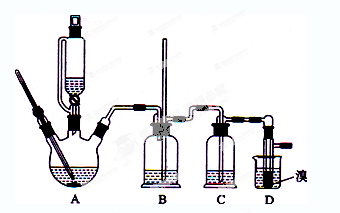
有关数据列表如下:
| | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用 的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
下列实验装置(部分固定装置略去)和有关叙述正确的是
| A.图1可以进行酸碱中和滴定实验 |
| B.图2可以进行中和热的测定实验 |
| C.图3可验证温度对化学平衡的影响 |
| D.图4可检验食盐水通电后的部分产物 |
下述实验方案能达到实验目的的是
| 编号 | A | B | C | D |
| 实验 方案 |  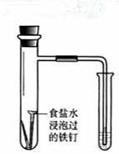 食盐水 |  片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 | 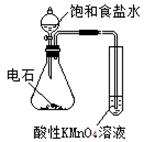 | 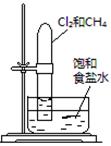 置于光亮处 |
| 实验 目的 | 验证铁钉发生 析氢腐蚀 | 验证Fe电极被保护 | 验证乙炔的还原性 | 验证甲烷与氯气发生 化学反应 |
已知:Ki1(H2CO3)> Ki1(H2S)。现有以下试剂:盐酸、醋酸、苯酚、碳酸钙、醋酸钠溶液、硫化钠溶液,用下图所示装置进行下列实验,无法达到实验目的的是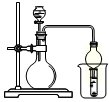
| A.比较醋酸、苯酚、碳酸的酸性 |
| B.比较盐酸、醋酸、碳酸的酸性 |
| C.比较醋酸、氢硫酸、碳酸的酸性 |
| D.比较盐酸、碳酸、氢硫酸的酸性 |
下列关于各实验装置图的叙述中正确的是( )

| A.装置①:构成锌—铜原电池 |
| B.装置②:除去Cl2中含有的少量HCl |
| C.装置③:验证溴乙烷发生消去反应生成烯烃 |
| D.装置④:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH |
下列各实验装置图的叙述中,正确的是( )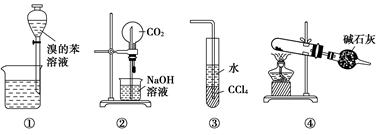
| A.装置①为放出萃取溴水后的苯层 |
| B.装置②为喷泉实验 |
| C.装置③可用来吸收HCl气体 |
| D.以NH4Cl为原料,装置④可用于制备少量NH3 |