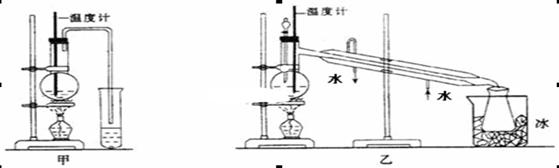
题目内容
下列图中的实验方案,能达到实验目的的是
A
解析试题分析:A.2NO2(g)  N2O4.(g) ΔH<O. 将两个NO2平衡球分别放在热水、冰水中。平衡球放在热水中颜色加深,放在冰水中颜色变浅。说明升高温度,化学平衡向逆反应方向移动,降低温度,化学平衡向正反应方向移动。可见是温度不同化学反应移动的方向不同。正确。B.在复分解反应中,一般是强酸制取弱酸。发生反应:2HCl+Na2CO3=2NaCl+H2O+CO2↑证明:酸性HCl >H2CO3;H2O+CO2+Na2SiO3= Na2CO3+H2SiO3↓. 证明:酸性H2CO3>H2SiO3。但由于HCl有挥发性,挥发出的HCl也会与Na2SiO3发生反应:2HCl+Na2SiO3="2NaCl+" H2SiO3↓.故不能证明酸性:HCl >H2CO3>H2SiO3。错误。C.CO2、SO2都会与溶液中的Na2CO3反应。因此不能达到除去杂质的目的。错误。要验证FeCl3溶液对H2O2的分解有催化作用,应该是其它外界条件相同,只有一个加催化剂,另一个对比的不加催化剂才可以,不能同时有两个变量。错误。
N2O4.(g) ΔH<O. 将两个NO2平衡球分别放在热水、冰水中。平衡球放在热水中颜色加深,放在冰水中颜色变浅。说明升高温度,化学平衡向逆反应方向移动,降低温度,化学平衡向正反应方向移动。可见是温度不同化学反应移动的方向不同。正确。B.在复分解反应中,一般是强酸制取弱酸。发生反应:2HCl+Na2CO3=2NaCl+H2O+CO2↑证明:酸性HCl >H2CO3;H2O+CO2+Na2SiO3= Na2CO3+H2SiO3↓. 证明:酸性H2CO3>H2SiO3。但由于HCl有挥发性,挥发出的HCl也会与Na2SiO3发生反应:2HCl+Na2SiO3="2NaCl+" H2SiO3↓.故不能证明酸性:HCl >H2CO3>H2SiO3。错误。C.CO2、SO2都会与溶液中的Na2CO3反应。因此不能达到除去杂质的目的。错误。要验证FeCl3溶液对H2O2的分解有催化作用,应该是其它外界条件相同,只有一个加催化剂,另一个对比的不加催化剂才可以,不能同时有两个变量。错误。
考点:考查对比法在化学理论教学中的作用的知识。

练习册系列答案
相关题目
根据下列实验操作和现象所得出的结论不正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向等浓度且较稀的NaCl、KI混合 液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 向溶液x中滴加浓NaOH溶液, 将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
| C | 溴乙烷与NaOH溶液共热后,加入 AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷没有发生水解 |
| D | 将SO2通入溴水中 | 溴水褪色 | SO2具有还原性 |
下列实验装置(部分固定装置略去)和有关叙述正确的是
| A.图1可以进行酸碱中和滴定实验 |
| B.图2可以进行中和热的测定实验 |
| C.图3可验证温度对化学平衡的影响 |
| D.图4可检验食盐水通电后的部分产物 |
已知:Ki1(H2CO3)> Ki1(H2S)。现有以下试剂:盐酸、醋酸、苯酚、碳酸钙、醋酸钠溶液、硫化钠溶液,用下图所示装置进行下列实验,无法达到实验目的的是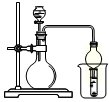
| A.比较醋酸、苯酚、碳酸的酸性 |
| B.比较盐酸、醋酸、碳酸的酸性 |
| C.比较醋酸、氢硫酸、碳酸的酸性 |
| D.比较盐酸、碳酸、氢硫酸的酸性 |
下列实验方案不能达到实验目的的是:
| | 实验目的 | 实验方案 |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液 |
| C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入足量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 |
| D | 探究温度对化学平衡的影响 | 将NO2球浸泡在冷、热水中,观察颜色的变化 |
下列实验方法和解释或结论都正确的是
| | 实验目的 | 实验方法 | 解释或结论 |
| A | 检验CH2=CH-CHO中含碳碳双键 | 将丙烯醛溶液滴入溴水中,溴水褪色 | 丙烯醛中碳碳双键与溴单质发生了加成反应 |
| B | 确认某无机酸浓溶液的溶质 | 用蘸有浓氨水的玻璃棒放于试剂瓶口,有大量白烟 | 该无机酸一定为盐酸 |
| C | 鉴别一份红棕色气体成分 | 湿润的淀粉碘化钾试纸插入气体中,试纸变蓝 | 该气体一定为Br2 |
| D | 探究高级脂肪酸甘油酯水解的条件 | 高级脂肪酸甘油酯中加入NaOH溶液加热后不再分层 | 高级脂肪酸甘油酯发生皂化反应 |
下列有关实验现象和解释或结论都正确的选项是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| B | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变浅 | 反应2NO2 N2O4的ΔH<0 |
| D | 向AgCl沉淀中滴加KI溶液 | 白色沉淀 变为黄色 | 溶度积:AgI比 AgCl更小 |
下列实验方案不能达到实验目的的是( )
| | 实验目的 | 实验方案 |
| A | 探究接触面积对化学反应速率的影响 | 相同温度下,取等质量的大理石块、大理石粉分别投入等体积、等浓度的盐酸中 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2 mL 1 mol·L-1 NaOH溶液中先加入3滴1 mol·L-1 MgCl2溶液,再加入3滴1 mol·L-1 FeCl3溶液 |
| C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入适量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 |
| D | 测定铝箔中氧化铝的含量 | 取a g铝箔与足量稀盐酸充分反应,逸出的气体通过碱石灰后,测其体积为b L(已转化为标准状况下) |
 H2O + CH3CH2—O—CH2CH3 (乙醚)
H2O + CH3CH2—O—CH2CH3 (乙醚)