题目内容
(14分)碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5 mol·L-1MgSO4溶液和0.5 mol·L-1NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL三口烧瓶中,开启搅拌器。温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤、洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
回答下列问题:
步骤3中加氨水后的离子方程式 。
(2)测定合成的MgCO3·nH2O中的n值。称量1.000 g碳酸镁晶须,放入如图所示的广口瓶中加入水滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,反应后期将温度升到30 ℃,最后的烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。

①图中气球的作用是 。
②上述反应后期要升温到30℃,主要目的是 。
③用已知浓度的盐酸滴定烧杯中的溶液时应选用 为指示剂,若盛放盐酸的滴定管在滴定前有气泡未排尽,滴定后无气泡(其他操作均正确),则所测CO2的量会 (填“偏大”“偏小”“无影响”)
④设3次实验测得每1.000 g碳酸镁晶须与稀硫酸反应产生的CO2平均值为a mol,则n值为 (用含a的表达式表示)。
(3)称取100 g上述晶须产品进行热重分析,热重曲线如图。则该条件下合成的晶须中,n= (选填1、2、3、4、5)。
(1) NH3·H2O+Mg2++HCO ===MgCO3↓+NH
===MgCO3↓+NH +H2O
+H2O
(2)①暂时储存CO2,有利于CO2被NaOH溶液吸收,且能保持装置中压强相对稳定
②使溶解在水中的CO2逸出,便于吸收 ③甲基橙,偏大 ④(1-84a)/18a (3)1
解析试题分析:(1)氨水是弱碱,与碳酸氢镁反应的离子方程式为NH3·H2O+Mg2++HCO ===MgCO3↓+NH
===MgCO3↓+NH +H2O。
+H2O。
(2)①装置中气球可以暂时储存CO2,有利于CO2被NaOH溶液吸收,且能保持装置中压强相对稳定。②反应后期将温度升到30℃,使生成的二氧化碳全部逸出后被氢氧化钠溶液吸收,减少测定产生的误差。
③用盐酸滴定时,反应后溶液显酸性,因此应该选择甲基橙作指示剂。若盛放盐酸的滴定管在滴定前有气泡未排尽,滴定后无气泡(其他操作均正确),则导致消耗盐酸溶液的体积增加,从而使所测CO2的量会偏大。
④实验测得每1.000g碳酸镁晶须产生的CO2平均值为a mol,依据元素守恒可知,碳酸镁物质的量为amol,根据化学式可知,MgCO3?nH2O中碳酸镁晶体中碳酸镁和结晶水物质的量之比为1:n,得到1:n=a: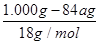 ;得到n=(1-84a)/18a。
;得到n=(1-84a)/18a。
(3)MgCO3?nH2O中n=1~5,分析图象400°C剩余质量为82.3g,为失去结晶水的质量,剩余质量为39.2g是碳酸镁分解失去二氧化碳的质量,得到100g×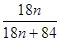 =100-82.3,n=1。
=100-82.3,n=1。
考点:考查物质制备实验方案的设计和分析判断

已知:Ki1(H2CO3)> Ki1(H2S)。现有以下试剂:盐酸、醋酸、苯酚、碳酸钙、醋酸钠溶液、硫化钠溶液,用下图所示装置进行下列实验,无法达到实验目的的是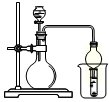
| A.比较醋酸、苯酚、碳酸的酸性 |
| B.比较盐酸、醋酸、碳酸的酸性 |
| C.比较醋酸、氢硫酸、碳酸的酸性 |
| D.比较盐酸、碳酸、氢硫酸的酸性 |
下列化学实验或操作能够达到目的的是
| A.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量 |
| B.欲除去蛋白质溶液中的NaCl而又不改变其性质,可加入适量BaCl2溶液后过滤 |
| C.测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
| D.为了证明焦炉气中含有氢气,可将焦炉气通过灼热的氧化铜粉末,看黑色粉末是否变红色 |
(1)小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。
①需要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”)。
②写出该反应的离子方程式 。
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250 mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00 mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000 mol·L-1 KMnO4溶液装入 (填“酸式”或“碱式”)滴定管,进行滴定操作。
在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因:
。当____
,证明达到滴定终点。
③计算:再重复上述操作2次,记录实验数据如下。
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 1.10 | 21.10 |
则消耗KMnO4溶液的平均体积为 mL,已知H2C2O4的相对分子质量为90,则此样品的纯度为 。
④误差分析:下列操作会导致测定结果偏高的是 。
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视

 H2O + CH3CH2—O—CH2CH3 (乙醚)
H2O + CH3CH2—O—CH2CH3 (乙醚)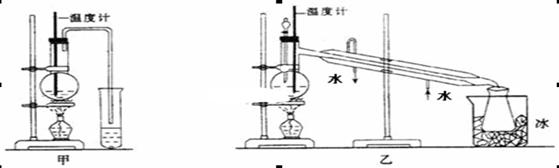

 Na2S2O3(aq) (III)
Na2S2O3(aq) (III) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0 

 杂质)。向滤液中加入足量Ca(OH)2溶液,然后再加入足量CH3COOH溶液,观察现象。
杂质)。向滤液中加入足量Ca(OH)2溶液,然后再加入足量CH3COOH溶液,观察现象。