题目内容
12.下列离子方程式的书写正确的是( )| A. | 稀硫酸与Ba(OH)2溶液反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 向氯化亚铁溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- | |
| C. | 铁和稀盐酸的反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 碳酸镁与稀硫酸的反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
分析 A.漏掉氢离子与氢氧根离子的反应;
B.电荷不守恒;
C.不符合反应客观事实;
D.碳酸镁与稀硫酸的反应生成硫酸镁和二氧化碳和水.
解答 解:A.稀硫酸与Ba(OH)2溶液反应,离子方程式:2H++2OH-+SO42-+Ba2+═BaSO4↓+2H2O,故A错误;
B.向氯化亚铁溶液中通入Cl2,离子方程式:2Fe2++Cl2═2Fe3++2Cl-,故B错误;
C.铁和稀盐酸的反应生成二价铁离子,离子方程式:Fe+2H+═Fe2++H2↑,故C错误;
D.碳酸镁与稀硫酸的反应,离子方程式:MgCO3+2H+═Mg2++H2O+CO2↑,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,熟悉发生反应实质是解题关键,注意化学式的拆分、原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
2.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 15g甲基(-CH3)所含的电子数为9NA | |
| B. | 300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA | |
| C. | 标准状况下,22.4LCH4气体与足量Cl2反应可生成NA个CH3Cl分子 | |
| D. | 80mL 10mol/L浓盐酸与足量MnO2反应,转移电子数为0.4NA |
3.X、Y、P、Q四种短周期元素,元素X在地壳中含量最高,充有元素Y单质蒸气的灯透雾能力强,常用于道路和广场的照明,Q的最外层电子数与其电子总数比为3:8,P的单质常用作电脑的芯片材料.下列说法正确的是( )
| A. | 元素Y、P的简单氢化物中化学键类型相同 | |
| B. | 原子半径:X>Y | |
| C. | 最高价氧化物的水化物酸性:P<Q | |
| D. | X、Q两元素的最高正化合价相同 |
20.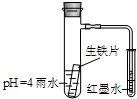 如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )
如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )
 如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )
如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )| A. | 生铁片中的碳是原电池的阳极,发生氧化反应 | |
| B. | 雨水酸性较强,生铁片仅发生析氢腐蚀 | |
| C. | 导管内液面回升时,碳极反应式为:O2+4e-+2H2O=4OH- | |
| D. | 具支试管中溶液pH逐渐减小 |
7.下列各组物质中,所含分子数相同的是( )
| A. | 10g O2和10gH2 | B. | 5.6LN2(标准状况)和11gCO2 | ||
| C. | 9gH2O和0.5molBr2 | D. | 224mL H2(标准状况)和0.1molN2 |
17.天然水中含有细小悬浮颗粒或胶体颗粒,可用混凝剂进行净化处理,下述物质不能作为混凝剂的是( )
| A. | 碱式氯化铝 | B. | 明矾 | C. | 绿矾 | D. | 胆矾 |
4.下列说法中不正确的是( )
| A. | 大多数有机物难溶于水,易溶于汽油、酒精、苯等有机溶剂;大多有机反应较慢,常伴有副反应发生,需催化 | |
| B. | 乙烯和苯分子中都有碳碳双键,分子中所有原子都共平面;溴苯、硝基苯、四氯化碳,它们的密度都比水大 | |
| C. | 乙烯和苯互为同系物 | |
| D. | 苯和四氯化碳都能使溴水褪色,都不能使酸性高锰酸钾溶液褪色;一定条件下,苯能与液溴或浓硝酸发生取代反应,也能与H2发生加成反应 |
1.化学与生活是紧密相连的,下列说法不正确的是( )
| A. | 铁能被磁铁吸引,且纯铁比生铁更易生锈 | |
| B. | 向煤中加入适量石灰石,可大大减少燃烧产物中SO2的量 | |
| C. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| D. | 维生素C能帮助人体将食物中摄取的Fe3+转化为Fe2+,因为维生素具有还原性 |
2.有关气体制备所用试剂及检验气体所用试剂完全正确的组合是( )
| A. | O2:二氧化锰和双氧水 带火星的木条 | |
| B. | Cl2:二氧化锰和浓盐酸 品红溶液 | |
| C. | CO2:大理石和稀硫酸 澄清石灰水 | |
| D. | NH3:NH4Cl固体和NaOH固体 湿润的红色石蕊试纸 |