题目内容
3.X、Y、P、Q四种短周期元素,元素X在地壳中含量最高,充有元素Y单质蒸气的灯透雾能力强,常用于道路和广场的照明,Q的最外层电子数与其电子总数比为3:8,P的单质常用作电脑的芯片材料.下列说法正确的是( )| A. | 元素Y、P的简单氢化物中化学键类型相同 | |
| B. | 原子半径:X>Y | |
| C. | 最高价氧化物的水化物酸性:P<Q | |
| D. | X、Q两元素的最高正化合价相同 |
分析 X、Y、P、Q四种短周期元素,元素X在地壳中含量最高,应为O元素,充有元素Y单质蒸气的灯透雾能力强,常用于道路和广场的照明,则Y为Na元素,Q的最外层电子数与其电子总数比为3:8,则Q为S元素,P的单质常用作电脑的芯片材料,应为Si元素,结合对应的单质、化合物的性质以及元素周期率知识解答该题.
解答 解:X、Y、P、Q四种短周期元素,元素X在地壳中含量最高,应为O元素,充有元素Y单质蒸气的灯透雾能力强,常用于道路和广场的照明,则Y为Na元素,Q的最外层电子数与其电子总数比为3:8,则Q为S元素,P的单质常用作电脑的芯片材料,应为Si元素,
A.Y为Na、对应的氢化物NaH为离子化合物,P为Si,对应的氢化物为共价化合物,故A错误;
B.一般来说,原子核外电子层数越多,原子半径越大,故B错误;
C.非金属性Si<S,元素的非金属性越强,对应的最高价氧化物的水化物酸性越强,故C正确;
D.X、Q两元素的最高正化合价分别为0、+6,故D错误.
故选C.
点评 本题考查原子结构与元素周期律的关系,根据原子结构明确元素种类为解答该题的关键,注意把握原子结构特点以及元素周期律的递变规律,为解答该题的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.如表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为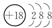 .
.
(2)表中能形成两性氢氧化物的元素是铝(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为(用化学式表示)KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4.
(4)③元素与⑩元素两者核电荷数之差是26.
(5)请写出②的氢化物发生催化氧化的化学方程式4NH3+5O2 4NO+6H2O.
4NO+6H2O.
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
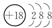 .
.(2)表中能形成两性氢氧化物的元素是铝(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为(用化学式表示)KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4.
(4)③元素与⑩元素两者核电荷数之差是26.
(5)请写出②的氢化物发生催化氧化的化学方程式4NH3+5O2
 4NO+6H2O.
4NO+6H2O.
18.在0.1mol/L(NH4)2SO4溶液中,离子浓度最大的是( )
| A. | SO42- | B. | NH4+ | C. | H+ | D. | OH- |
15.下列实验能达到目的是( )
| A. | 用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 | |
| B. | 用Cu与S共热制备CuS | |
| C. | 用品红和盐酸检验Na2SO3和Na2CO3 | |
| D. | 将混有乙烯的SO2通入酸性KMnO4溶液中除去乙烯 |
12.下列离子方程式的书写正确的是( )
| A. | 稀硫酸与Ba(OH)2溶液反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 向氯化亚铁溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- | |
| C. | 铁和稀盐酸的反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 碳酸镁与稀硫酸的反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
13.蛋白质发生的下列反应中,可逆的是( )
| A. | 盐析 | B. | 变性 | C. | 煮熟 | D. | 加入硫酸钠 |
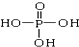 、
、 交换后的溶液用0.1mol•L-1的NaOH溶液滴定.在消耗NaOH溶液 42.00mL和50.00mL时各有一个滴定终点.请回答:
交换后的溶液用0.1mol•L-1的NaOH溶液滴定.在消耗NaOH溶液 42.00mL和50.00mL时各有一个滴定终点.请回答: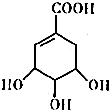 莽草酸的结构简式如图.请回答:
莽草酸的结构简式如图.请回答: CO气体还原FeO固体可以得到Fe固体,铁的化合物具有重要的应用.
CO气体还原FeO固体可以得到Fe固体,铁的化合物具有重要的应用.