题目内容
2.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )| A. | 15g甲基(-CH3)所含的电子数为9NA | |
| B. | 300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA | |
| C. | 标准状况下,22.4LCH4气体与足量Cl2反应可生成NA个CH3Cl分子 | |
| D. | 80mL 10mol/L浓盐酸与足量MnO2反应,转移电子数为0.4NA |
分析 A、根据甲基没有发生电子转移计算出15g甲基中含有的电子数;
B、从水溶液中含有水分子分析判断;
C、CH4气体与Cl2的反应生成的CH3Cl能继续和氯气反应;
D、依据浓盐酸随着反应进行,浓度变稀后不再与二氧化锰反应进行解答.
解答 解:A、15g甲基的物质的量为1mol,含有9mol电子,所以15 g甲基(-CH3)所含的电子数为9NA,故A正确;
B、300mL2mol/L蔗糖溶液中含蔗糖分子0.6mol,但溶液中还有水分子,故B错误;
C、CH4气体与Cl2的反应生成的CH3Cl能继续和氯气反应,能生成一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳的混合物,根据碳原子的守恒可知,一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳的物质的量之和为1mol,则生成的CH3Cl的物质的量小于1mol,分子个数小于NA个,故C错误;
D、80 mL 10mol•L-1浓盐酸含0.8molHCl,浓盐酸与足量MnO2混合加热,随着反应进行浓盐酸浓度变稀后不再与二氧化锰进行反应,所以0.8mol HCl不能全部反应,故转移电子数不是0.4NA,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
13.如表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为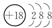 .
.
(2)表中能形成两性氢氧化物的元素是铝(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为(用化学式表示)KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4.
(4)③元素与⑩元素两者核电荷数之差是26.
(5)请写出②的氢化物发生催化氧化的化学方程式4NH3+5O2 4NO+6H2O.
4NO+6H2O.
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
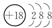 .
.(2)表中能形成两性氢氧化物的元素是铝(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为(用化学式表示)KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4.
(4)③元素与⑩元素两者核电荷数之差是26.
(5)请写出②的氢化物发生催化氧化的化学方程式4NH3+5O2
 4NO+6H2O.
4NO+6H2O.
17.过渡元素在生活、生产和科技等方面有广泛的用途.现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子.
下列说法中错误的是 ( )
下列说法中错误的是 ( )
| A. | PFS中铁显+3价 | |||||||||||||||
| B. | 铁原子的价电子排布式是3d74s1 | |||||||||||||||
| C. | 由FeSO4溶液制PFS需经过氧化、水解和聚合的过程 | |||||||||||||||
| D. | 由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
| |||||||||||||||
7.下列烷烃中,一氯代物的同分异构体种数最多的是( )
| A. | 异丁烷 | B. | 2-甲基丁烷 | C. | 丙烷 | D. | 3-乙基戊烷 |
12.下列离子方程式的书写正确的是( )
| A. | 稀硫酸与Ba(OH)2溶液反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 向氯化亚铁溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- | |
| C. | 铁和稀盐酸的反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 碳酸镁与稀硫酸的反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
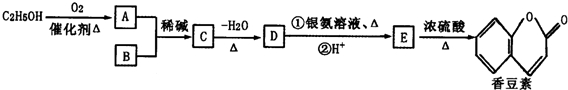
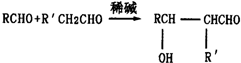 (R、R′为烃基或氢原子)
(R、R′为烃基或氢原子)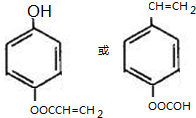 .
.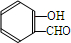 $\stackrel{NaOH}{→}$
$\stackrel{NaOH}{→}$ 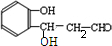 .
.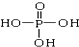 、
、 交换后的溶液用0.1mol•L-1的NaOH溶液滴定.在消耗NaOH溶液 42.00mL和50.00mL时各有一个滴定终点.请回答:
交换后的溶液用0.1mol•L-1的NaOH溶液滴定.在消耗NaOH溶液 42.00mL和50.00mL时各有一个滴定终点.请回答: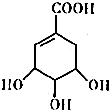 莽草酸的结构简式如图.请回答:
莽草酸的结构简式如图.请回答: