题目内容
7.下列各组物质中,所含分子数相同的是( )| A. | 10g O2和10gH2 | B. | 5.6LN2(标准状况)和11gCO2 | ||
| C. | 9gH2O和0.5molBr2 | D. | 224mL H2(标准状况)和0.1molN2 |
分析 所含分子数相等,说明两种物质的物质的量相等,根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$计算其物质的量来判断即可.
解答 解:所含分子数相等,说明两种物质的物质的量相等,
A.根据n=$\frac{m}{M}$知,两种气体的质量相等但摩尔质量分别为32g/mol、2g/mol不等,所以其物质的量不等,所以分子数不等,故A错误;
B.标况下氮气物质的量=$\frac{V}{{V}_{m}}$=$\frac{5.6L}{22.4L/mol}$=0.25mol,11gCO2的物质的量n=$\frac{m}{M}$=$\frac{11g}{44g/mol}$=0.25mol,所以二者分子数相等,故B正确;
C.9gH2O的物质的量n=$\frac{m}{M}$=$\frac{9g}{18g/mol}$=0.5mol,0.5molBr2,所以二者分子数相等,故C正确;
D.标况下,224mL H2物质的量n=$\frac{V}{{V}_{m}}$=$\frac{0.224L}{22.4mol/L}$=0.01mol,0.01mol氮气,二者的物质的量不等,所以其分子数不等,故D错误;
故选BC.
点评 本题考查物质的量的计算,侧重考查分析计算能力,明确物质的量公式中各个物理量的关系即可解答,在使用气体摩尔体积时注意适用范围及适用条件,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
17.过渡元素在生活、生产和科技等方面有广泛的用途.现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子.
下列说法中错误的是 ( )
下列说法中错误的是 ( )
| A. | PFS中铁显+3价 | |||||||||||||||
| B. | 铁原子的价电子排布式是3d74s1 | |||||||||||||||
| C. | 由FeSO4溶液制PFS需经过氧化、水解和聚合的过程 | |||||||||||||||
| D. | 由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
| |||||||||||||||
18.在0.1mol/L(NH4)2SO4溶液中,离子浓度最大的是( )
| A. | SO42- | B. | NH4+ | C. | H+ | D. | OH- |
15.下列实验能达到目的是( )
| A. | 用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 | |
| B. | 用Cu与S共热制备CuS | |
| C. | 用品红和盐酸检验Na2SO3和Na2CO3 | |
| D. | 将混有乙烯的SO2通入酸性KMnO4溶液中除去乙烯 |
2.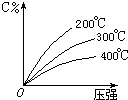 可逆反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
 可逆反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )| A. | 达平衡后,加入催化剂则C%增大 | |
| B. | 化学方程式中n>e+f | |
| C. | 达平衡后,若升温,平衡右移 | |
| D. | 达平衡后,增加A的量有利于平衡向右移动 |
12.下列离子方程式的书写正确的是( )
| A. | 稀硫酸与Ba(OH)2溶液反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 向氯化亚铁溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- | |
| C. | 铁和稀盐酸的反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 碳酸镁与稀硫酸的反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
19.下列广告语中,你认为符合科学道理的是( )
| A. | “超纯水”、“超纯蒸馏水”绝对卫生,对人体有益 | |
| B. | 含碘食盐可防治甲状腺肿大,但也不能滥补,造成体内碘含量过高 | |
| C. | 本饮料由纯天然物质配置而成,绝对不含化学物质,对人体无害 | |
| D. | 含氟牙膏可适合任何人群预防龋齿 |
16.下列关于化学键和化合物的说法中正确的是( )
| A. | 化学键的形成一定伴随着电子的得失 | |
| B. | 金属元素和非金属元素形成的化合物一定是离子化合物 | |
| C. | 含有阴离子的化合物一定含有阳离子 | |
| D. | 非金属元素组成的化合物一定是共价化合物 |

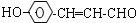 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$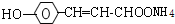 +2Ag↓+3NH3+H2O,反应类型为氧化反应
+2Ag↓+3NH3+H2O,反应类型为氧化反应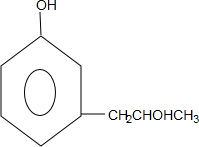 ,G的结构简式
,G的结构简式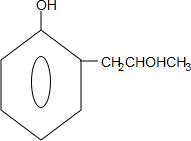 .
.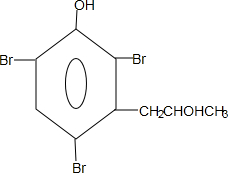 能够溶于有机物,不溶于水,所以在NaOH溶液中出现白色沉淀
能够溶于有机物,不溶于水,所以在NaOH溶液中出现白色沉淀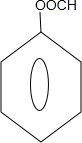 ,
,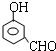 或
或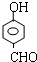 或
或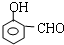 .
.