题目内容
【题目】(1)已知金刚石中C—C键能小于C60中C—C键能,有同学据此认为C60的熔点高于金刚石,认为此说法是否正确__(填“正确”或“不正确”),并闸述理由__。
(2)格式试剂RMgX(R表示烃基、X表示卤素)遇水剧烈反应,生成可燃性烃RH和__。
(3)64g自燃性气体SiH4在25℃、101Kpa下充分完全燃烧生成液态水和固态氧化物时放出akJ热量,写出该自燃性气体燃烧热的热化学方程式__。
【答案】不正确 C60是分子晶体,熔化时破坏的是分子间作用力,无需破坏攻共价键,而分子间作用力较弱,所需能量较低,金刚石是原子晶体,熔化时破坏共价键,C60故熔点低于金刚石 Mg(OH)X或[MgX2和Mg(OH)2] SiH4(g)+ 2O2(g) = SiO2(s) +2H2O(l) ΔH =![]() kJ·mol1
kJ·mol1
【解析】
⑴C60是分子晶体,金刚石是原子晶体。
⑵根据原子守恒和RMgX和水反应生成可燃性烃RH得另外产物。
⑶1mol SiH4燃烧放出![]() kJ热量。
kJ热量。
⑴虽然金刚石中C—C键能小于C60中C—C键能,C60是分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键,而分子间作用力较弱,所需能量较低,金刚石是原子晶体,熔化时破坏共价键,故C60熔点低于金刚石;故答案为:不正确;C60是分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键,而分子间作用力较弱,所需能量较低,金刚石是原子晶体,熔化时破坏共价键,故C60熔点低于金刚石。
⑵格式试剂RMgX(R表示烃基、X表示卤素)遇水剧烈反应,RMgX和水反应生成可燃性烃RH,根据原子守恒,则另外产物可能为Mg(OH)X或[MgX2和Mg(OH)2];故答案为:Mg(OH)X或[MgX2和Mg(OH)2]。
⑶64g自燃性气体SiH4即物质的量为2mol,在25℃、101Kpa下充分完全燃烧生成液态水和固态氧化物时放出akJ热量,则1mol SiH4燃烧放出![]() kJ热量,因此该自燃性气体燃烧热的热化学方程式SiH4(g)+ 2O2(g) = SiO2(s) +2H2O(l) ΔH =
kJ热量,因此该自燃性气体燃烧热的热化学方程式SiH4(g)+ 2O2(g) = SiO2(s) +2H2O(l) ΔH =![]() kJ·mol1;故答案为:SiH4(g)+ 2O2(g) = SiO2(s) +2H2O(l) ΔH =
kJ·mol1;故答案为:SiH4(g)+ 2O2(g) = SiO2(s) +2H2O(l) ΔH =![]() kJ·mol1。
kJ·mol1。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】乙烯是一种重要的化工原料,可由乙烷为原料制取,回答下列问题。
(1)传统的热裂解法和现代的氧化裂解法的热化学方程式如下:
①C2H6(g)=C2H4(g)+H2(g) ΔH1=+136kJ·mol-1
②C2H6(g)+![]() O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
已知反应相关的部分化学键键能数据如下:
化学键 | H-H(g) | H-O(g) | O=O |
键能(kJ·mol-1) | 436 | x | 496 |
由此计算x=___,通过比较ΔH1和ΔH2,说明和热裂解法相比,氧化裂解法的优点是___(任写一点)。
(2)乙烷的氧化裂解反应产物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),图甲为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是___,反应的最佳温度为___(填序号)。
A.700℃ B.750℃ C.850℃ D.900℃
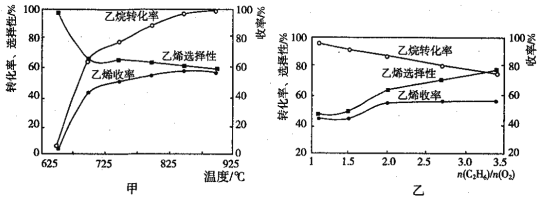
[乙烯选择性=![]() ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
(3)烃类氧化反应中,氧气含量低会导致反应产生积炭堵塞反应管。图乙为![]() 的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中
的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中![]() 的最佳值是___,判断的理由是___。
的最佳值是___,判断的理由是___。
(4)工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___。反应达平衡时,各组分的体积分数如下表:
组分 | C2H6 | O2 | C2H4 | H2O | 其他物质 |
体积分数/% | 2.4 | 1.0 | 12 | 15 | 69.6 |
计算该温度下的平衡常数:Kp=___(用平衡分压代替平衡浓度,平衡分压=总压×体积分数)。