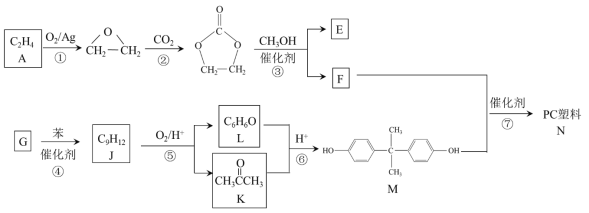
题目内容
【题目】乙烯是一种重要的化工原料,可由乙烷为原料制取,回答下列问题。
(1)传统的热裂解法和现代的氧化裂解法的热化学方程式如下:
①C2H6(g)=C2H4(g)+H2(g) ΔH1=+136kJ·mol-1
②C2H6(g)+![]() O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
已知反应相关的部分化学键键能数据如下:
化学键 | H-H(g) | H-O(g) | O=O |
键能(kJ·mol-1) | 436 | x | 496 |
由此计算x=___,通过比较ΔH1和ΔH2,说明和热裂解法相比,氧化裂解法的优点是___(任写一点)。
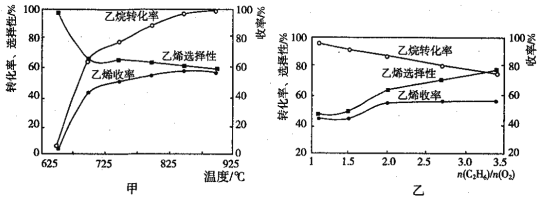
(2)乙烷的氧化裂解反应产物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),图甲为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是___,反应的最佳温度为___(填序号)。
A.700℃ B.750℃ C.850℃ D.900℃
[乙烯选择性=![]() ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
(3)烃类氧化反应中,氧气含量低会导致反应产生积炭堵塞反应管。图乙为![]() 的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中
的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中![]() 的最佳值是___,判断的理由是___。
的最佳值是___,判断的理由是___。
(4)工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___。反应达平衡时,各组分的体积分数如下表:
组分 | C2H6 | O2 | C2H4 | H2O | 其他物质 |
体积分数/% | 2.4 | 1.0 | 12 | 15 | 69.6 |
计算该温度下的平衡常数:Kp=___(用平衡分压代替平衡浓度,平衡分压=总压×体积分数)。
【答案】465 氧化裂解反应是放热反应,节约能源(或氧化裂解反应热力学趋势上大) 温度升高,反应速率加快,转化率升高 C 2.0 比值小于2.0时,乙烯的收率降低;比值大于2.0时,乙烯的收率并未增加且产生更多的积炭,堵塞反应管 正反应是气体分子数增多的反应,恒压充入惰性气体相当于扩大容器体积,降低分压,有利于平衡正向移动 75(kPa)0.5
【解析】
(1)根据盖斯定律,得出H2(g)+![]() O2(g)=H2O(g)的反应热,再根据△H=反应物的总键能生成物的总键能,可求出x的值;
O2(g)=H2O(g)的反应热,再根据△H=反应物的总键能生成物的总键能,可求出x的值;
(2)温度升高,化学反应速率加快,根据图象,随温度升高,乙烷的转换率越高;综合乙烯的转化率和选择性,图中即可对应找出最佳的反应温度;
(3)含氧量高,会造成积炭,要根据图象找出乙烯收率高而相对积炭少的点,即图中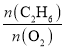 的比值为2时最佳;
的比值为2时最佳;
(4)根据平衡常数与反应物、生成物的关系,并且将浓度关系转变为分压关系来解答。
(1)根据盖斯定律,②①得到:H2(g)+![]() O2(g)═H2O(g) △H=246kJ/mol,根据键能关系△H=反应物的总键能生成物的总键能=436+496/22x=246,x=465;由热化学方程式可以看出,热裂解法是吸热反应,需要消耗能源,氧裂解法是放热反应,不需要从外界得到能量,故答案为:465;氧化裂解反应是放热反应,节约能源(或氧化裂解反应热力学趋势上大);
O2(g)═H2O(g) △H=246kJ/mol,根据键能关系△H=反应物的总键能生成物的总键能=436+496/22x=246,x=465;由热化学方程式可以看出,热裂解法是吸热反应,需要消耗能源,氧裂解法是放热反应,不需要从外界得到能量,故答案为:465;氧化裂解反应是放热反应,节约能源(或氧化裂解反应热力学趋势上大);
(2)由图可知,随温度的升高,乙烷的转化率在升高,考虑化学反应速率的影响因素,温度越高,反应速率越快;由图,要乙烷的转化率尽可能高,而副产物又相对较少,及乙烯的选择性较高,应找到乙烯收率较高时的温度,对应下温度在850左右,故答案为:温度升高,反应速率加快,转化率升高;C;
(3)由(2)分析可知,我们要选择乙烯收率较高的点,在图2中,比值小于2时,乙烯收率随比值增大在上升,比值大于2时,乙烯的收率并未增加,并且氧含量值在降低,会造成积炭,故答案为:2.0;比值小于2.0时,乙烯的收率降低;比值大于2.0时,乙烯的收率并未增加且产生更多的积炭,堵塞反应管;
(4)C2H6(g)+![]() O2(g)=C2H4(g)+H2O(g)反应是体积在增大的反应,充入惰性气体,总压恒定,分压就降低了,压强降低会促使反应向体积增大的方向移动,即正向移动。根据平衡常数的表达式Kp=
O2(g)=C2H4(g)+H2O(g)反应是体积在增大的反应,充入惰性气体,总压恒定,分压就降低了,压强降低会促使反应向体积增大的方向移动,即正向移动。根据平衡常数的表达式Kp=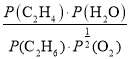 =75(kPa)0.5,故答案为:75(kPa)0.5。
=75(kPa)0.5,故答案为:75(kPa)0.5。