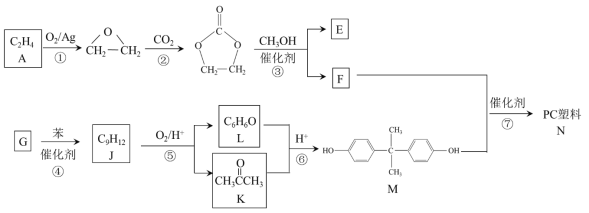
题目内容
【题目】有效去除大气中的NOx(主要是NO和NO2)是环境保护的重要课题。
(1)用Pl-g-C3N4光催化氧化法脱除NO的过程如图-1所示。在酸性水溶液中,光催化脱除原理和电化学反应原理类似。g-C3N4端的反应:O2+2H++2e-=H2O2,Pl端的反应:___。

(2)次氯酸盐脱除NO的主要过程如下:
①NO+HClO=NO2+HCl
②NO+NO2+H2O![]() 2HNO2
2HNO2
③HClO+HNO2=HNO3+HCl
下列分析正确的是___。
a.烟气中含有的少量O2能提高NO的脱除率
b.NO2单独存在时不能被脱除
c.脱除过程中,次氯酸盐溶液的pH下降
(3)NaClO溶液能有效脱除NO。25℃时,NO的脱除率随pH的变化如图-2所示;pH=4时,NO的脱除率随温度的变化如图-3所示。
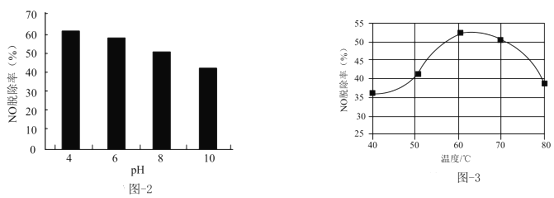
①25℃时,随着pH降低,NO的脱除率增大的原因:___。
②pH=4时,60~80℃NO的脱除率下降的原因:___。
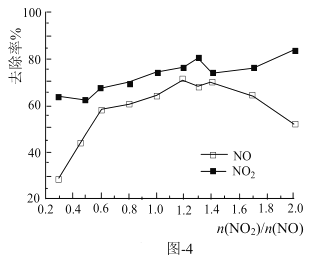
(4)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入Ca(OH)2悬浊液中,改变![]() ,NOx的去除率如图-4所示。
,NOx的去除率如图-4所示。
已知:NO与Ca(OH)2不反应;
NOx的去除率=1-![]() ×100%
×100%
①![]() 在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___。
在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___。
②当![]() 大于1.4时,NO2去除率升高,但NO去除率却降价。其可能的原因是___。
大于1.4时,NO2去除率升高,但NO去除率却降价。其可能的原因是___。
③O3与NO反应的方程式为:NO+O3=NO2+O2,(该条件下不考虑O2与NO的反应)。保持NO的初始浓度不变,改变n(O3)/n(NO),将反应后的混合气体通入Ca(OH)2悬浊液中吸收。为节省O3的用量,又能保持NOx总去除效果好,则![]() 合适的值范围为___。(保留两位小数)
合适的值范围为___。(保留两位小数)
【答案】NO2e-+H2O=2H++NO2 ac pH降低,ClO-+H+=HClO,溶液中c(HClO)增大 HClO受热分解,溶液中c(HClO)减小 NO+NO2+Ca(OH)2=Ca2++2NO2-+H2O NO2量太多,剩余的NO2和水反应生成NO逸出,导致NO去除率降低 0.55~0.58
【解析】
(1)g-C3N4端得电子,那么Pl端失电子,结合电荷守恒、原子守恒可写P1端离子方程式;
(2)次氯酸盐脱除NO的主要过程可看出,脱NO的本质是转换成HNO3;
(3)NaClO脱NO的过程可看出,实际上是HClO与NO反应,所以pH变化HClO跟着变化,脱NO效果也会跟着变化;
(4)NO和Ca(OH)2不反应,NO、NO和Ca(OH)2三者反应,分析化合价可知产物为亚硝酸钙,在此基础上分析解答。
(1)g-C3N4端得电子发生还原反应,生成过氧化氢,P1端NO失电子变成NO2,这样左边就出现了正电荷,右边加H+,结合原子守恒,左边应加H2O,所以P1端的离子方程式为:NO2e-+H2O=2H++NO2,故答案为:NO2e-+H2O=2H++NO2;
(2)a.从给出的条件看,次氯酸盐脱除NO是先将一部分NO氧化成NO2才脱出的,O2和NO反应生成NO2,就省了第一步了,所以烟气中含有的少量O2能提高NO的脱除率,a正确;
b.从原理上看,氮氧化物转换为HNO3就被脱出了,NO2单独存在时能和水反应生成HNO3和NO,有一定的脱出率,b错误;
c.次氯酸盐水解显碱性,从原理来看,最后生成硝酸和HCl,pH下降,c正确;
故答案为:ac;
(3)①pH降低,c(H+)增大,产生更多的HClO,所以NO的脱除率增大,故答案为:pH降低,ClO-+H+=HClO,溶液中c(HClO)增大;
②HClO会分解,温度太高,HClO分解得太多,溶液中HClO浓度减小了,故答案为:HClO受热分解,溶液中c(HClO)减小;
(4)①NO和Ca(OH)2不反应,所以反应物有NO、NO2和Ca(OH)2,根据氧化还原规律,产物为Ca(NO2)2和水,所以离子方程式为:NO+NO2+Ca(OH)2=Ca2++2NO2-+H2O,故答案为:NO+NO2+Ca(OH)2=Ca2++2NO2-+H2O;
②当![]() 太大,NO2量太多,吸收不完,有一部分NO2就和水反应生成硝酸和NO,这样就导致NO2去除率升高,但NO去除率却降价,故答案为:NO2量太多,剩余的NO2和水反应生成NO逸出,导致NO去除率降低;
太大,NO2量太多,吸收不完,有一部分NO2就和水反应生成硝酸和NO,这样就导致NO2去除率升高,但NO去除率却降价,故答案为:NO2量太多,剩余的NO2和水反应生成NO逸出,导致NO去除率降低;
③从图上看NOx总去除效果最好时,![]() 介于1.2到1.4之间,设NO的物质量为1,那么则NO2的物质的量为1.2介于1.4之间,由NO+O3=NO2+O2可知,此时消耗O3和NO的量均为1.2到1.4之间,所以O3的量为1.2-1.4,NO的量为(1.2+1)到(1.4+1)之间,即
介于1.2到1.4之间,设NO的物质量为1,那么则NO2的物质的量为1.2介于1.4之间,由NO+O3=NO2+O2可知,此时消耗O3和NO的量均为1.2到1.4之间,所以O3的量为1.2-1.4,NO的量为(1.2+1)到(1.4+1)之间,即![]() 在
在![]() 到
到![]() ,即0.55到0.58之间,故答案为:0.55~0.58。
,即0.55到0.58之间,故答案为:0.55~0.58。

 备战中考寒假系列答案
备战中考寒假系列答案