题目内容
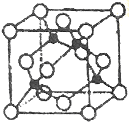
【题目】将两种硫酸盐按一定比例混合后共熔,可制得化合物M(化学式为xK2SO4·yCr2(SO4)3),若将2.83g化合物M中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81gI2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr2O72-+3I2+7H2O,若向溶有2.83gM的溶液中,加入过量的BaCl2溶液,过滤洗涤干燥后可得到4.66g白色沉淀。
由此推断出化合物M中x:y为__。写出简要计算过程:__。
【答案】1:1 3.81gI2即物质的量![]() ,根据方程式得到Cr2O72的物质的量n(Cr2O72)=
,根据方程式得到Cr2O72的物质的量n(Cr2O72)= ![]() n(I2)=
n(I2)= ![]() ×0.015mol =0.005mol,则n[Cr2(SO4)3] =0.005mol,Cr2(SO4)3中硫酸根的物质的量n(SO42) = 0.015mol,若向溶有2.83gM的溶液中,加入过量的BaCl2溶液,过滤洗涤干燥后可得到4.66g白色沉淀即得到硫酸钡沉淀物质的量
×0.015mol =0.005mol,则n[Cr2(SO4)3] =0.005mol,Cr2(SO4)3中硫酸根的物质的量n(SO42) = 0.015mol,若向溶有2.83gM的溶液中,加入过量的BaCl2溶液,过滤洗涤干燥后可得到4.66g白色沉淀即得到硫酸钡沉淀物质的量![]() ,则n(SO42) =0.02mol,说明K2SO4中硫酸根的物质的量为n(SO42) =0.02mol 0.015mol =0.005mol,则n(K2SO4) =0.005mol,因此M中x:y = 0.005mol:0.005mol =1:1;M的化学式为K2SO4Cr2(SO4)3。
,则n(SO42) =0.02mol,说明K2SO4中硫酸根的物质的量为n(SO42) =0.02mol 0.015mol =0.005mol,则n(K2SO4) =0.005mol,因此M中x:y = 0.005mol:0.005mol =1:1;M的化学式为K2SO4Cr2(SO4)3。
【解析】
先计算I2的物质的量,根据离子方程式得到n(Cr2O72),根据原子守恒得到n[Cr2(SO4)3]和Cr2(SO4)3中硫酸根的物质的量n(SO42),再计算硫酸钡的物质的量,根据守恒得到整个物质中的n(SO42),得出K2SO4中硫酸根的物质的量,再得n(K2SO4),最后得到比例关系。
将2.83g化合物M中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81gI2即物质的量![]() ,反应的离子方程式为:Cr2O72+6I-+14H+=2Cr2O72+3I2+7H2O,那反应得到n(Cr2O72)=
,反应的离子方程式为:Cr2O72+6I-+14H+=2Cr2O72+3I2+7H2O,那反应得到n(Cr2O72)= ![]() n(I2)=
n(I2)= ![]() ×0.015mol =0.005mol,则n[Cr2(SO4)3] =0.005mol,Cr2(SO4)3中硫酸根的物质的量n(SO42) = 0.015mol,若向溶有2.83gM的溶液中,加入过量的BaCl2溶液,过滤洗涤干燥后可得到4.66g白色沉淀即得到硫酸钡沉淀物质的量
×0.015mol =0.005mol,则n[Cr2(SO4)3] =0.005mol,Cr2(SO4)3中硫酸根的物质的量n(SO42) = 0.015mol,若向溶有2.83gM的溶液中,加入过量的BaCl2溶液,过滤洗涤干燥后可得到4.66g白色沉淀即得到硫酸钡沉淀物质的量![]() ,则n(SO42) =0.02mol,说明K2SO4中硫酸根的物质的量为n(SO42) =0.02mol 0.015mol =0.005mol,则n(K2SO4) =0.005mol,因此M中x:y = 0.005mol:0.005mol =1:1;M的化学式为K2SO4Cr2(SO4)3;故答案为:1:1;3.81gI2即物质的量
,则n(SO42) =0.02mol,说明K2SO4中硫酸根的物质的量为n(SO42) =0.02mol 0.015mol =0.005mol,则n(K2SO4) =0.005mol,因此M中x:y = 0.005mol:0.005mol =1:1;M的化学式为K2SO4Cr2(SO4)3;故答案为:1:1;3.81gI2即物质的量![]() ,根据方程式得到Cr2O72的物质的量n(Cr2O72)=
,根据方程式得到Cr2O72的物质的量n(Cr2O72)= ![]() n(I2)=
n(I2)= ![]() ×0.015mol =0.005mol,则n[Cr2(SO4)3] =0.005mol,Cr2(SO4)3中硫酸根的物质的量n(SO42) = 0.015mol,若向溶有2.83gM的溶液中,加入过量的BaCl2溶液,过滤洗涤干燥后可得到4.66g白色沉淀即得到硫酸钡沉淀物质的量
×0.015mol =0.005mol,则n[Cr2(SO4)3] =0.005mol,Cr2(SO4)3中硫酸根的物质的量n(SO42) = 0.015mol,若向溶有2.83gM的溶液中,加入过量的BaCl2溶液,过滤洗涤干燥后可得到4.66g白色沉淀即得到硫酸钡沉淀物质的量![]() ,则n(SO42) =0.02mol,说明K2SO4中硫酸根的物质的量为n(SO42) =0.02mol 0.015mol =0.005mol,则n(K2SO4) =0.005mol,因此M中x:y = 0.005mol:0.005mol =1:1;M的化学式为K2SO4Cr2(SO4)3。
,则n(SO42) =0.02mol,说明K2SO4中硫酸根的物质的量为n(SO42) =0.02mol 0.015mol =0.005mol,则n(K2SO4) =0.005mol,因此M中x:y = 0.005mol:0.005mol =1:1;M的化学式为K2SO4Cr2(SO4)3。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案