题目内容
4.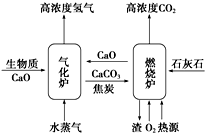 Ⅰ、由生物质能通过绿色化学途径制取氢气是当前能源发展的一个重要方向.如图表示的是以CaO为吸收体,将生物质经与水蒸气反应制取H2的流程(生物质简写为C).
Ⅰ、由生物质能通过绿色化学途径制取氢气是当前能源发展的一个重要方向.如图表示的是以CaO为吸收体,将生物质经与水蒸气反应制取H2的流程(生物质简写为C).其中气化炉和燃烧炉中分别发生的主要反应如表所示:
| 气化炉 | 燃烧炉 |
| ①C(s)+H2O(g)?CO(g)+H2(g)△H=+131.6kJ•mol-1 ②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1 ③CaO(s)+CO2(g)?CaCO3(s)△H=-178.3kJ•mol-1 | ④C(s)+O2(g)═CO2(g) △H=-393.8kJ•mol-1 ⑤CaCO3(s)?CaO(s)+CO2(g) K |
(1)气化炉中的总反应为C(s)+2H2O(g)+CaO(s)═CaCO3(s)+2H2(g)△H=-87.9 kJ•mol-1.
(2)燃烧炉中反应⑤所需的能量由反应④提供.如果生成1mol CaO,至少需通入纯氧0.453mol.(留三位小数点)
(3)下表列出的是当只改变温度或压强时,反应⑤中CO2的浓度和CaCO3的残留率的变化.
 | 0 | 5 | 10 | 15 | 20 | 25 |
| T1 | 0 | 1.5 | 2.3 | 4.0 | 4.0 | 4.0 |
| T2 | 0 | 1.0 | 1.8 | 2.8 | 3.1 | 3.1 |
 | 0 | 5 | 10 | 15 | 20 | 25 |
| p1 | 1 | 0.90 | 0.83 | 0.75 | 0.75 | 0.75 |
| p2 | 1 | 0.58 | 0.35 | 0.31 | 0.30 | 0.30 |
Ⅱ、以熔融碳酸盐(Li2CO3)为电解质,一氧化碳-空气燃料电池的负极反应式为CO-2e-+CO32-=2CO2.在标准状况下,11.2L氧气参与反应,理论上转移的电子数为2NA(或1.204×1024).
分析 (1)根据盖斯定律构造目标热化学方程式,据此计算反应热;
(2)由反应③可知,反应⑤再生1mol CaO吸收178.3kJ热量,结合反应④的反应热计算需要氧气物质的量;
(3)图表数据分析可知一定压强下随时间增大,生产二氧化碳增多,说明温度升高平衡正向进行,正反应为吸热反应,平衡常数增大,不同温度下随温度升高二氧化碳增大,T1>T2,图表2可知P1状态在相同时间内残留率大于P2,反应是气体体积增大的反应,增大压强平衡逆向进行,碳酸钙残留率增大;
Ⅱ、(4)该燃料电池中,通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-═4CO2,通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2═2CO32-,以此解答该题.
解答 解:Ⅰ、(1)已知:①C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6kJ•mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2kJ•mol-1
③CaO(s)+CO2(g)=CaCO3(s)△H=-178.3kJ•mol-1
根据盖斯定律,①+②+③得C(s)+2H2O(g)+CaO(s)=CaCO3(s)+2H2(g),
故△H=+131.6kJ•mol-1+(-41.2kJ•mol-1)+(-178.3kJ•mol-1)=-87.9kJ•mol-1,
故答案为:-87.9;
(2)由反应③可知,反应⑤再生1mol CaO吸收178.3kJ热量,由反应④C(s)+O2(g)=CO2(g)△H=-393.8kJ•mol-1可知,需要氧气物质的量=$\frac{178.3KJ/mol}{393.8KJ/mol}$=0.453mol,
故答案为:0.453;
(3)图表数据分析可知一定压强下随时间增大,生产二氧化碳增多,说明温度升高平衡正向进行,正反应为吸热反应,平衡常数增大,不同温度下随温度升高二氧化碳增大,T1>T2,反应是气体体积增大的反应,增大压强平衡逆向进行,碳酸钙残留率增大,图表2可知P1状态在相同时间内残留率大于P2,则P1>P2,
故答案为:增大,>,>;
Ⅱ、通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-═4CO2,正极上的电极反应式为O2+4e-+2CO2═2CO32-,总反应式为:2CO+O2═2CO2,熔融盐中CO32-的物质的量浓度不变,依据电子守恒在标准状况下,11.2L氧气物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol参与反应,理论上转移的电子数=0.5mol×4×NA=2NA(或1.204×1024),
故答案为:CO-2e-+CO32-=2CO2,2NA(或1.204×1024);
点评 本题考查反应热有关计算、化学平衡影响因素分析判断,原电池原理分析应用,主要是图表数据分析和平衡移动原理的理解,掌握基础是关键,题目难度中等,.

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案| A. | 气态氢化物水溶液的酸性依次减弱 | |
| B. | 氯水、溴水、碘水都能使淀粉碘化钾试纸变蓝 | |
| C. | 气态氢化物的稳定性随原子序数的增大而增强 | |
| D. | 原子核外最外层电子数随原子序数的增大而增多 |
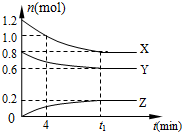 在2L密闭容器中有X、Y、Z三种气体间恒温下发生的可逆反应,它们的物质的量随时间变化而变化的曲线如图所示.下列分析正确的是( )
在2L密闭容器中有X、Y、Z三种气体间恒温下发生的可逆反应,它们的物质的量随时间变化而变化的曲线如图所示.下列分析正确的是( )| A. | 4 min内 v(Z)=0.025 mol•L-1•min-1 | |
| B. | Y的平衡转化率为75% | |
| C. | 平衡常数K=(25/12)(mol•L-1)-2 | |
| D. | t1 min时充入少量He,平衡向正向移动 |
| A. | Na+、NH4+、AlO2-、SiO32- | B. | Ca2+、NH4+、NH3﹒H2O、CH3COO- | ||
| C. | Cr2O72-、H+、C2H5OH、NO3- | D. | Cu2+、SO42-、HS-、Cl- |
| A. | 大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染 | |
| B. | 方便面的制作过程中常用到纯碱,葡萄酒中一般加入少量SO2作为添加剂 | |
| C. | 油脂、淀粉、纤维素、蛋白质等都能在人体内水解并提供能量 | |
| D. | 二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾的主要组成 |
| A. | 澄清的石灰水 | B. | 氯气 | C. | 浓硫酸 | D. | 氢硫酸溶液 |
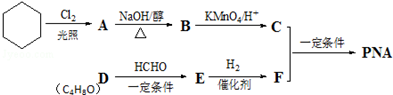
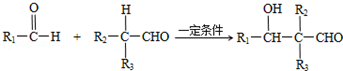 (R1、R2、R3代表烃基或氢原子)
(R1、R2、R3代表烃基或氢原子)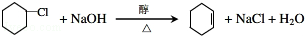 .
.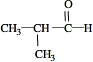 .
.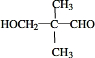 .若一次取样,检验E中所含官能团,按使用顺序加入试剂为Na、银氨溶液(或新制的Cu(OH)2悬浊液).
.若一次取样,检验E中所含官能团,按使用顺序加入试剂为Na、银氨溶液(或新制的Cu(OH)2悬浊液).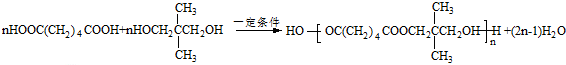 .
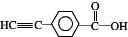
.
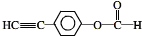 .
.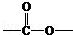 基团
基团