题目内容
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。以氟碳铈矿(主要含 CeFCO3)为原料制备 CeO2 的一种工艺流程如下:
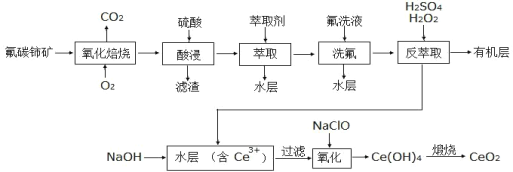
已知:①CeO2具有较强的氧化性,难溶于一般的酸或碱。
②F—能和很多金属离子形成较为稳定的配合物,如Ce4+能与 F—结合成CeF3+,Al3+也能与 F—结合成 AlF63-;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
③Ce4+能被萃取剂 TBP 萃取,而 Ce3+不能。回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_____。
(2)氧化焙烧后的固体产物中含有 CeO2 和 CeF4 物质的量之比为 3:1,“酸浸”时发生反应的离子方程式为_____________。传统工艺中用盐酸替代硫酸,其缺点为________________。
(3)TBP是一种有机萃取剂,“萃取”时存在反应CeF3++TBP![]() CeTBP4++F-,氟洗液中添加 Al3+的作用是________________。
CeTBP4++F-,氟洗液中添加 Al3+的作用是________________。
(4)“反萃取”步骤中发生反应的离子方程式为________________。
(5)反萃取后的水层溶液中 c(Ce3+)=1mol/L,c(Al3+)= 0.01mol/L,应先加入 NaOH 溶液调节溶液的___<pH<_______ ,除去 Al3+后,再加入 NaOH 调节溶液的 pH 大于_____(保留一位小数),即可确保 Ce3+已完全沉淀。(已知:常温下,当溶液中的某离子浓度小于 1.0×10-5mol·L-1时,可认为该离子沉淀完全。Ksp[Al(OH)3]=1.0×10-32,Ksp[Ce(OH)3]=1.0×10-21)。
(6)CeO2是汽车尾气净化催化剂的关键成分,在尾气消除过程中发生着 CeO2 与 CeO2(1-x) (0≤x≤0.25)的相互转化。写出 CeO2 消除 CO尾气的化学方程式:______________。
(7)CeO2(1-x)中的 Ce为+3、+4 价,测定 x的值可判断它们的比例。现取 CeO2(1-x)固体 0.8280 g,加入足量硫酸和 0.0110 molFeSO4·7H2O充分溶解,使 Ce4+全部被还原成 Ce3+,再用 0.1000 mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗 20.00 mL 标准溶液。(已知氧化性:Ce4+>KMnO4)
①x的值为_____。
②若加入的 FeSO4·7H2O 部分变质,会导致测定的 x 值_____(填“偏高”“偏低”或“不变”)。
【答案】增大接触面积,加快反应速率。 3CeO2 + CeF4+12H+=4CeF3+ + 6H2O 会生成Cl2,污染环境。 Al3+能与F—结合成AlF63- ,使萃取平衡正向移动 2CeTBP4++H2O2![]() 2Ce3++O2↑+ 2H+ +TBP 4 7 8.7 CeO2 + 2xCO=CeO2(1-x) + 2xCO2 0.2 偏低
2Ce3++O2↑+ 2H+ +TBP 4 7 8.7 CeO2 + 2xCO=CeO2(1-x) + 2xCO2 0.2 偏低
【解析】
氟碳铈矿(主要含CeFCO3),“氧化焙烧”的目的是将+3价铈氧化成+4价,Ce4+能与F-结合成CeF3+,有利于酸浸,加稀硫酸,与SO42-结合成[CeSO4]2+,加萃取剂,氟洗液,硫酸体系中Ce4+能被萃取剂TBP萃取,而Ce3+不能,“反萃取”,加H2O2,又将Ce4+还原为Ce3+,发生反应2Ce4++H2O2=2Ce3++O2↑+2H+,加入碱后Ce3+转化为沉淀,加NaClO,氧化Ce3+为Ce4+,得到产品。
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是增大固体和氧气的接触面积加快反应速率,提高原料利用率,故答案为:增大接触面积,加快反应速率。
(2)加硫酸“酸浸”时,其发生的离子反应方程式为:3CeO2 + CeF4+12H+=4CeF3+ + 6H2O,若盐酸替代硫酸,会产生大量黄绿色气体应为氯气,污染环境,故答案为:3CeO2 + CeF4+12H+=4CeF3+ + 6H2O;会生成Cl2,污染环境。
(3)由已知信息可知,Al3+能与F—结合成AlF63-,“萃取”时,发生反应CeF3++TBP![]() CeTBP4++F-,加入Al3+与F-结合,c(F-)减小,可逆反应平衡正向移动,有利于萃取,故答案为:Al3+能与F—结合成AlF63- ,使萃取平衡正向移动。
CeTBP4++F-,加入Al3+与F-结合,c(F-)减小,可逆反应平衡正向移动,有利于萃取,故答案为:Al3+能与F—结合成AlF63- ,使萃取平衡正向移动。
(4)反萃取”加H2O2的作用是将Ce4+离子重新还原为Ce3+,其离子反应方程式为2CeTBP4++H2O2![]() 2Ce3++O2↑+ 2H+ +TBP,H2O2在该反应中作还原剂,故答案为:2CeTBP4++H2O2
2Ce3++O2↑+ 2H+ +TBP,H2O2在该反应中作还原剂,故答案为:2CeTBP4++H2O2![]() 2Ce3++O2↑+ 2H+ +TBP。
2Ce3++O2↑+ 2H+ +TBP。
(5)已知:c(Al3+)= 0.01mol/L,Ksp[Al(OH)3]=c(Al3+)·c3(OH-)=1.0×10-32,c(OH-)=1.0×10-10,c(H+)=1.0×10-4,pH=4;c(Ce3+)=1mol/L,Ksp[Ce(OH)3]=c(Ce3+)·c3(OH-)=1.0×10-21,c(OH-)=1.0×10-7,c(H+)=1.0×10-7,pH=7;所以应先加入 NaOH 溶液调节溶液的4<pH<7,除去Al3+;c(Ce3+)=1.0×10-5mol·L-1,Ksp[Ce(OH)3]=c(Ce3+)·c3(OH-)=1.0×10-21,c3(OH-)=1.0×10-16,c3(H+)=1.0×10-26,pH![]() ,所以再加NaOH调节溶液的 pH 大于8.7,Ce3+已完全沉淀,故答案为:4;7;8.7。
,所以再加NaOH调节溶液的 pH 大于8.7,Ce3+已完全沉淀,故答案为:4;7;8.7。
(6)CeO2与CO反应生成CeO2(1-x)与CO2,其化学反应方程式为:CeO2 + 2xCO=CeO2(1-x) + 2xCO2,故答案为:CeO2 + 2xCO=CeO2(1-x) + 2xCO2。
(7)用 0.1000 mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗 20.00 mL 标准溶液,主要是氧化溶液中剩余的Fe2+,根据MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,剩余Fe2+的物质的量为0.1000 mol·L-1×0.02L×5=0.01mol,则还原Ce4+消耗的Fe2+的物质的量为0.01100mol-0.01mol=0.001mol,根据Ce4++Fe2+=Fe3++Ce3+,则Ce4+的物质的量为0.001mol。
①0.8280 g CeO2(1-x) 的物质的量为![]() ,设Ce3+为amol,则
,设Ce3+为amol,则![]() ,再根据化学式中正负化合价代数之和为零,得出CeO2(1-x)中Ce元素的化合价为+4(1-x),则
,再根据化学式中正负化合价代数之和为零,得出CeO2(1-x)中Ce元素的化合价为+4(1-x),则![]() 将
将![]() 代入
代入![]() 中,得出x=0.2,故答案为:0.2。
中,得出x=0.2,故答案为:0.2。
②加入的 FeSO4·7H2O 部分变质,属于亚铁离子的物质的量减少,消耗标准液体积减小,所以Ce4+的物质的量偏多,会导致测定的 x 值偏低,故答案为:偏低。

 习题精选系列答案
习题精选系列答案【题目】葡萄酒中的酒精是葡萄果实中的糖发酵后的产物(C6H12O6![]() 2CH3CH2OH+2CO2↑)。
2CH3CH2OH+2CO2↑)。
Ⅰ.已知:实验室制乙烯原理为CH3CH2OH![]() CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
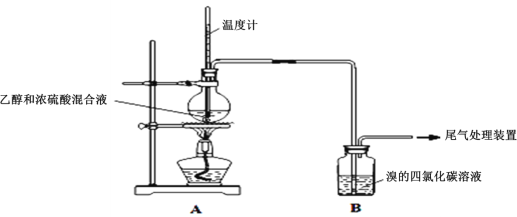
操作 | 现象 |
点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
…… | |
实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)溶液“渐渐变黑”,说明浓硫酸具有___性。
(2)对产生的气体进行分析,甲认为是C2H4,乙认为不能排除SO2的作用。
①写出实验室制取SO2的化学反应方程式是___;
②乙根据现象认为实验中产生的SO2和___,使B中有色物质反应褪色。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色。
乙:用下列装置按一定顺序与A连接:(尾气处理装置略)
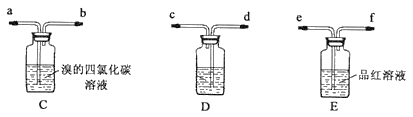
现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色。
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是___;乙设计的实验D中盛放的试剂是___,装置连接顺序为___ (用仪器接口字母编号)。
b.能说明确实是SO2使E中溶液褪色的实验是___。
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是___。由此可得出的干燥的SO2不能使Br2的四氯化碳溶液褪色。
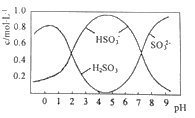
Ⅱ.葡萄酒中常用Na2S2O5做抗氧化剂。
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。写出Na2S2O5溶于水时溶液中离子浓度由大到小的排列顺序___。
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤___mol·L-1。