题目内容
【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.硫酸厂大量排放含SO2的尾气会对环境造成严重危害。
(1)工业上可利用废碱液(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,得到Na2SO3溶液,该反应的离子方程式为______。
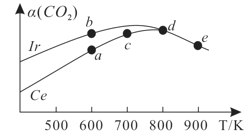
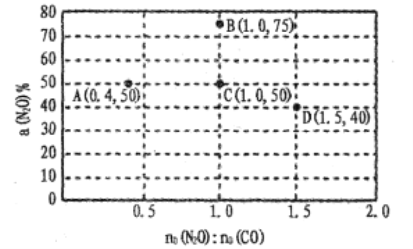
Ⅱ.沥青混凝土可作为反应;2CO(g)+O2(g)2CO2(g)的催化剂。如图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
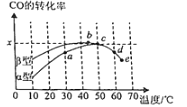
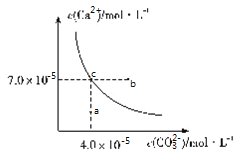
(2)a、b、c、d四点中,达到平衡状态的是______。
(3)已知c点时容器中O2浓度为0.02molL-1,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=______(用含x的代数式表示)。
(4)观察分析图,回答下列问题:

①CO转化反应的平衡常数K(a)______K(c)。
②在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要______(填“大”、“小”)。
③______点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高。
【答案】CO32-+SO2=SO32-+CO2 bcd ![]() > 大 e
> 大 e
【解析】
(1)工业上可利用废碱液(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,得到Na2SO3溶液,结合原子守恒、电荷守恒书写离子方程式;
(2)图象分析可知b点反应达到平衡状态,升温平衡逆向进行;
(3)一氧化碳降解反应2CO(g)+O2(g)2CO2(g),K=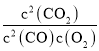 进行计算;
进行计算;
(4)①平衡常数是温度的函数,温度升高向吸热方向进行,即向逆反应方向进行,K=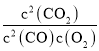 ,故K减小;
,故K减小;
②相同温度下β型沥青混凝土中CO降解速率比α型要大;
③温度越高,有效碰撞的几率越大;
(1)工业上可利用废碱液(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,得到Na2SO3溶液,结合原子守恒、电荷守恒书写离子方程式为:CO32-+SO2=SO32-+CO2;
(2)图象分析可知b点反应达到平衡状态,升温平衡逆向进行,a、b、c、d四点中,达到平衡状态的是bcd;
(3)CO的降解率为x,设起始CO浓度为1mol/L,
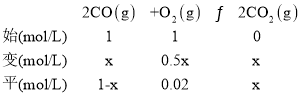
平衡常数K=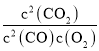 =
=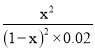 =
=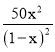 ;
;
(4)①平衡常数是温度的函数,温度升高向吸热方向进行,即向逆反应方向进行,K=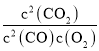 ,故K减小,即Ka>Kc;
,故K减小,即Ka>Kc;
②由图得,相同温度下β型沥青混凝土中CO降解速率比α型要大;
③温度越高,有效碰撞的几率越大,故e点的有效碰撞的几率是最大的;

【题目】碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备FeCO3的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8 mol/L FeSO4溶液 (pH=4.5) | 1 mol/L Na2CO3溶液 (pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min后出现明显的红褐色 |
0.8 mol/L FeSO4溶液 (pH=4.5) | 1 mol/L NaHCO3溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min后出现明显的灰绿色 | |
0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验I中红褐色沉淀产生的原因可用如下反应表示,请补全反应:_____________
![]() Fe2++
Fe2++ ![]() +
+ ![]() +
+ ![]() H2O
H2O ![]()
![]() Fe(OH)3 +
Fe(OH)3 + ![]() HCO3
HCO3
(2)实验II中产生FeCO3的离子方程式为__________________。
(3)为了探究实验III中NH4+所起的作用,甲同学设计了实验IV进行探究:
操作 | 现象 | |
实验IV | 向0.8 mol/L FeSO4溶液中加入________,再加入一定量Na2SO4固体配制成混合溶液(已知Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与2mL 1mol/L NaHCO3溶液混合 | 与实验III现象相同 |
实验IV中加入Na2SO4固体的目的是_________。
对比实验II、III、IV,甲同学得出结论:NH4+水解产生H+,降低溶液pH,减少了副产物Fe(OH)2的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:_________,再取该溶液一滴管,与2mL 1mol/L NaHCO3溶液混合。
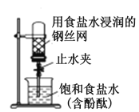
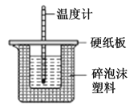
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验III中FeCO3的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验I、II、III中的沉淀进行过滤、洗涤、干燥后称量,然后转移至A处的广口瓶中。

① 补全A中装置并标明所用试剂。____________
② 为测定FeCO3的纯度,除样品总质量外,还需测定的物理量是____________。
(5)实验反思:经测定,实验III中的FeCO3纯度高于实验I和实验II。通过以上实验分析,制备FeCO3实验成功的关键因素是____________。