题目内容
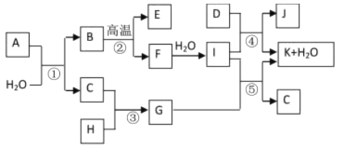
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:

回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
【答案】 +2 增加钛铁矿与硫酸按触面积,增大酸溶速率 2H++Fe==H2↑+Fe2+、Fe+2Fe3+==3Fe2+ 蒸发皿 TiO2++2H2O![]() TiO(OH)2+2H+ 促进水解( 或加快水解反应速率) 1.0×10-5 20:9
TiO(OH)2+2H+ 促进水解( 或加快水解反应速率) 1.0×10-5 20:9
【解析】钛铁矿[主要成分为钛酸亚铁(FeTiO)3,含有少量Fe2O3]加硫酸溶解生成TiO2+和Fe3+、Fe2+,加入铁还原铁离子:2Fe3++Fe=3Fe2+,得到硫酸亚铁和TiOSO4,对溶液蒸发浓缩、冷却结晶,过滤得到绿矾晶体和TiOSO4溶液,将TiOSO4溶液加热,促进TiO2+的水解生成TiO(OH)2,TiO2++2H2O=TiO(OH)2+2H+,分解得到钛白粉(TiO2);将绿矾与过氧化氢、H3PO4混合沉铁:2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+,将得到的FePO4与草酸、Li2CO3焙烧生成锂离子电池的正极材料LiFePO4。
(1)LiFePO4中Li的化合价为+1价,P为+5价O为-2价,根据正负化合价的代数和为0,Fe的化合价是+2,故答案为:+2;
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎可以增加钛铁矿与硫酸按触面积,增大酸溶速率,故答案为:增加钛铁矿与硫酸按触面积,增大酸溶速率;
(3)加入铁粉主要是还原铁离子,也会与过量的酸反应:2H++Fe==H2↑+Fe2+、2Fe3++Fe=3Fe2+;操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器为蒸发皿,故答案为:2H++Fe==H2↑+Fe2+、Fe+2Fe3+==3Fe2+;蒸发皿;
(4)TiO2+易水解生成TiO(OH)2,其水解的离子方程式为TiO2++2H2O![]() TiO(OH)2+2H+;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热可以促进水解,故答案为:TiO2++2H2O
TiO(OH)2+2H+;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热可以促进水解,故答案为:TiO2++2H2O![]() TiO(OH)2+2H+;促进水解;
TiO(OH)2+2H+;促进水解;
(5)Ksp(FePO4)= c(Fe3+) c(PO43-),则c(Fe3+)=![]() =
=![]() =1.0×10-5 mol/L,故答案为:1.0×10-5;
=1.0×10-5 mol/L,故答案为:1.0×10-5;
(6)“沉铁”的为绿矾与过氧化氢、H3PO4混合生成FePO4,离子方程式为:2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+,焙烧时的反应方程式为2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O+3CO2↑;H2O2与草酸(H2C2O4)的物质的量之比为1:1,则17% H2O2溶液与草酸(H2C2O4)的质量比为
2LiFePO4+H2O+3CO2↑;H2O2与草酸(H2C2O4)的物质的量之比为1:1,则17% H2O2溶液与草酸(H2C2O4)的质量比为![]() =
=![]() ,故答案为:
,故答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案