题目内容
【题目】下列曲线中,可以描述乙酸(甲, Ka=1.8×10-5)和一氯乙酸(乙, Ka=1.4×10-3)在水中的电离度与浓度关系的是()

A. A B. B C. C D. D
【答案】B
【解析】A、根据题给电离常数分析醋酸和一氯醋酸均为弱电解质且在相同温度、相同浓度时,醋酸的电离度小于一氯醋酸,即甲的电离度小于乙;弱电解质的浓度越大,电离度越小,与图像不符,错误;B、根据题给电离常数分析醋酸和一氯醋酸均为弱电解质且在相同温度、相同浓度时,醋酸的电离度小于一氯醋酸,即甲的电离度小于乙;弱电解质的浓度越大,电离度越小,与图像相符,正确;C、根据题给电离常数分析醋酸和一氯醋酸均为弱电解质且在相同温度、相同浓度时,醋酸的电离度小于一氯醋酸,即甲的电离度小于乙;弱电解质的浓度越大,电离度越小,与图像不符,错误;D、根据题给电离常数分析醋酸和一氯醋酸均为弱电解质且在相同温度、相同浓度时,醋酸的电离度小于一氯醋酸,即甲的电离度小于乙;弱电解质的浓度越大,电离度越小,与图像不符,错误。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
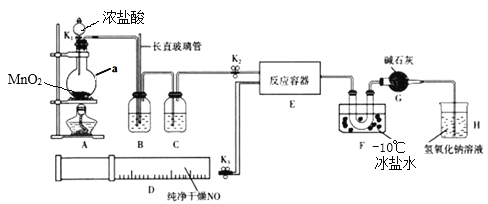
暑假接力赛新疆青少年出版社系列答案【题目】25 ℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
(1)HSO![]() 的电离平衡常数表达式K=______________________________。
的电离平衡常数表达式K=______________________________。
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______________。
【题目】CO和H2被称为合成气,用合成气可以合成乙酸。回答下列问题:
(1)已知CO、H2、CH3COOH的燃烧热ΔH分别为-283.0kJ/mol、-285.8kJ/mol、-1255.0kJ/mol,则用合成气合成CH3COOH(l)的可逆过程的热化学反应方程式为___________________________________________;
(2)在密闭容器中发生合成乙酸的反应,下列可以提高CH3COOH产率的措施有________。
A.恒温恒容,通入少量氦气 B.及时分离出产物乙酸
C.加入高效催化剂 D.压缩容器体积
(3)在150℃时,2L的密闭容器中发生反应:
2H2(g)+2CO(g)![]() CH3COOH(g) ΔH>0,起始通入4molH2和4molCO,CH3COOH蒸汽的浓度数据随时间变化如下表所示:
CH3COOH(g) ΔH>0,起始通入4molH2和4molCO,CH3COOH蒸汽的浓度数据随时间变化如下表所示:
时刻/min | 0 | 2 | 4 | 6 | 8 |
c(CH3COOH)/mol/L | 0 | 0.3 | 0.5 | 0.6 | 0.6 |
①0~2min内用CO表示该反应的速率为_________________,随着反应的进行速率逐渐减慢的可能原因是____________________________________________________;
②150℃时该反应的平衡常数的数值约为_________;(计算结果保留一位小数)
③平衡后再通入1molH2,则CH3COOH(g)的体积分数________,若再次通入1molH2和1molCO,则CH3COOH(g)的体积分数_________。(填“增大”“减小”或者“不变”)
(4)一定温度下,容积恒为1L的两个密闭容器之中进行如下实验:
实验编号 | 起始投料 |
① | 2molH2和2molCO |
② | 1molCH3COOH(g) |
则实验①中H2和实验②中CH3COOH的转化率随时间变化图示如下:
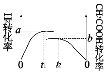
则a+b=_______,达到平衡的时间大小关系为t1__________t2。(填“>”“<”“不确定”)