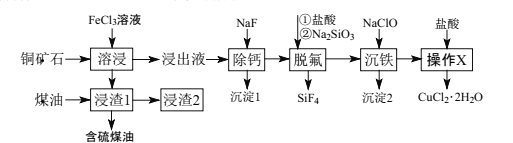
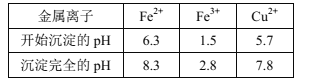
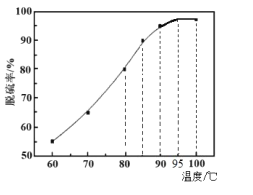
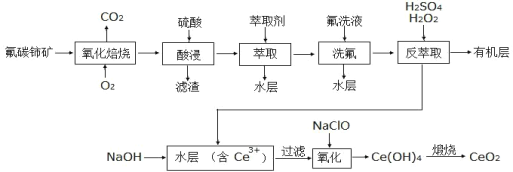
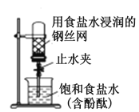
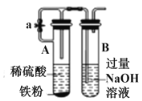
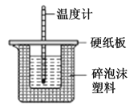
题目内容
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图所示变化规律(p表示压强,T表示温度,n表示物质的量):
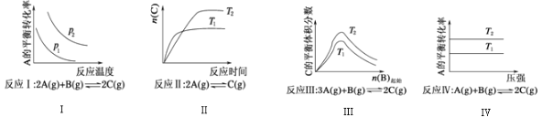
根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:△H>0,p2>p1
B.反应Ⅲ:△H>0,T2>T1或△H<0,T2<T1
C.反应Ⅱ:△H>0,T1>T2
D.反应Ⅳ:△H<0,T2>T1
【答案】B
【解析】
A.反应Ⅰ的特点是正反应方向为气体体积减小的方向,结合图象,压强增大,平衡正向移动,A的转化率应增大,所以p2>p1,从图像的走向可以看出,它随温度的升高A的转化率降低,即平衡逆向移动,逆反应是吸热反应,所以正反应为放热反应△H<0,故A错误;
B.关于反应Ⅲ,由图象可以看出,T2条件下C的平衡体积分数大,因此当T2>T1时,正反应为吸热反应△H>0,而当T2<T1时正反应为放热反应△H<0,故B正确;
C.关于反应Ⅱ由图象可以看出T1条件下达到平衡所用的时间少,所以T1>T2,而在T1条件下达平衡时n(C)小,所以说明低温有利于C的生成,故它主要的正反应为放热反应△H<0,故C错误;
D.关于反应Ⅳ,由图象可以看出T2条件下A的转化率大,因此当T2>T1时,说明升高温度平衡向正反应方向进行,因此正反应为吸热反应△H>0,故D错误;
答案选B。

【题目】研究高效催化剂是解决汽车尾气中的 NO 和 CO 对大气污染的重要途径。
(1)已知:C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
C(s)+![]() O2(g)= CO(g) △H2= -110.5 kJ/mol
O2(g)= CO(g) △H2= -110.5 kJ/mol
N2(g)+ O2(g)=2NO(g) △H3= +180.0 kJ/mol
则汽车尾气的催化转化反应 2NO(g)+ 2CO(g)=N2(g)+ 2CO2(g)的△H =_______kJ/mol。
(2)400℃时,在分别装有催化剂 A 和 B 的两个容积为 2 L 的刚性密闭容器中,各充入物质的量均为nmol的NO和CO发生上述反应。通过测定容器内总压强随时间变化来探究催化剂对反应速率的影响,数据如下表:
时间/min | 0 | 10 | 20 | 30 | ∞ |
A容器内压强/kPa | 75.0 | 70.0 | 65.0 | 60.0 | 60.0 |
B容器内压强/kPa | 75.0 | 71.0 | 68.0 | 66.0 | 60.0 |
①由上表可以判断催化剂 __________(填“A”或“B”) 的效果更好。
②容器中CO 的平衡转化率为 __________。400℃时,用压强表示的平衡常数Kp__________(kPa)-1 (保留两位小数)。
③汽车尾气排气管中使用催化剂可以提高污染物转化率,其原因是 __________。
(3)为研究气缸中NO的生成, 在体积可变的恒压密闭容器中,高温下充入物质的量均为 1mol 的氮气和氧气,发生反应 N2(g)+ O2(g)2NO(g)。
①下列说法能表明该反应已经达到平衡状态的是_________(填序号)。
A.2v正(O2)= v逆(NO) B.混合气体的平均相对分子质量不变
C.c(N2):c(O2)=l D.容器内温度不变
②为减小平衡混合气中 NO 的体积分数, 可采取的措施是 ___________。
(4)对于气缸中N的生成,化学家提出了如下反应历程:
第一步 O22O 慢反应
第二步 O+N2NO+N 较快平衡
第三步 N+O2NO+O 快速平衡
下列说法错误的是_______(填标号)。
A.第一步反应不从N2分解开始,是因为N2比O2稳定
B.N、O 原子均为该反应的催化剂
C.三步反应中第一步反应活化能最大
D.三步反应的速率都随温度升高而增大