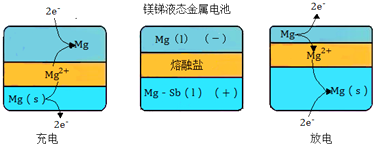
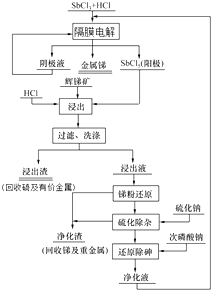
题目内容
10.下列实验操作或装置(略去部分夹持仪器)正确的是( )| A. | 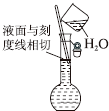 配制溶液 | B. | 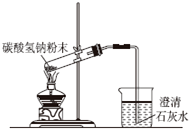 碳酸氢钠受热分解 | ||
| C. | 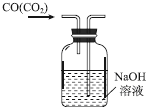 除去CO中的CO2 | D. | 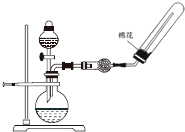 制备收集干燥的氨气 |
分析 A.定容时改用胶头滴管,使液面与刻度线相切;
B.碳酸氢钠受热分解生成水,应防止水倒流;
C.除杂时导管长进短出;
D.氨气的密度比空气小.
解答 解:A.定容时改用胶头滴管,使液面与刻度线相切,不能用烧杯加水,故A错误;
B.碳酸氢钠受热分解生成水,应防止水倒流,则试管口应略向下倾斜,故B错误;
C.除杂时导管长进短出,否则会将氢氧化钠溶液排出,故C错误;
D.氨气的密度比空气小,选向下排空气法收集,则导管应伸到试管底部,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的制备、混合物分离提纯、溶液配制等,把握物质的性质、反应原理、实验基本操作为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
16.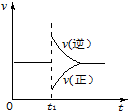 可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )
可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )
 可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )
可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )| A. | t1时改变某一条件,平衡将向逆反应方向移动 | |
| B. | 维持压强不变,t1时升高反应体系温度 | |
| C. | 维持温度不变,t1时扩大反应体系体积 | |
| D. | 维持温度、压强不变,t1时充入SO2(g) |
18.分类方法在化学学科发展中起到了非常重要的作用.下列分类标准合理的是( )
①根据其溶液是否导电,将物质分为电解质和非电解质
②依据反应中有无电子转移,将化学反应分为氧化还原反应和非氧化还原反应
③根据反应是否有离子参加将反应分为离子反应和非离子反应
④根据组成元素的种类,将纯净物分为单质和化合物
⑤根据分散系是否具有丁达尔效应,将分散系分为溶液、浊液和胶体.
①根据其溶液是否导电,将物质分为电解质和非电解质
②依据反应中有无电子转移,将化学反应分为氧化还原反应和非氧化还原反应
③根据反应是否有离子参加将反应分为离子反应和非离子反应
④根据组成元素的种类,将纯净物分为单质和化合物
⑤根据分散系是否具有丁达尔效应,将分散系分为溶液、浊液和胶体.
| A. | ①②③④ | B. | ②③④⑤ | C. | ②③④ | D. | ②③⑤ |
5.电池是人类生产和生活中的重要能量来源,各式各样电池的发明是化学对人类的一项重大贡献,下列有关电池的叙述正确的是( )
| A. | 锌锰干电池工作一段时间后碳棒变细 | |
| B. | 氢氧燃料电池可将热能直接转变为电能 | |
| C. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| D. | 氢氧燃料电池工作时氢气在负极被氧化 |
15.下列说法正确的是( )
| A. | 取少量卤代烃加NaOH水溶液共热,冷却,再加AgNO3溶液检验卤原子存在 | |
| B. | 用酸性KMnO4溶液检验溴乙烷与NaOH醇溶液共热后的产物是否是乙稀 | |
| C. | 用溴水鉴别乙烯与乙炔 | |
| D. | CH4和Cl2在光照条件下反应的产物最多可能有四种 |
2.2000年,国家药品监督管理局发布通告暂停使用和销售含苯丙醇胺的药品制剂.苯丙醇胺(英文缩写为PPA)结构简式如下: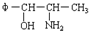 将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )
将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )
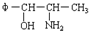 将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )
将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )| A. | 5 | B. | 7 | C. | 8 | D. | 9 |
19.臭氧(O3)和汽车尾气造成的大气污染物NO发生如下反应:NO+O3=NO2+2O、NO2+O=NO+O2从反应过程和最终产物分析判断,NO是( )
| A. | 氧化剂和还原产物 | B. | 还原剂和氧化产物 | ||
| C. | 氧化剂和催化剂 | D. | 还原剂和催化剂 |
20.如图为元素周期表短周期中的一部分,有关元素X、Y、Z、M的说法不正确的是( )
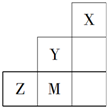

| A. | Y单质的氧化性比M单质的氧化性强 | |
| B. | X原子最外层可达到8电子的稳定结构 | |
| C. | 原子半径:Z>M>Y | |
| D. | M的气态氢化物的稳定性强于Z |