题目内容
5.电池是人类生产和生活中的重要能量来源,各式各样电池的发明是化学对人类的一项重大贡献,下列有关电池的叙述正确的是( )| A. | 锌锰干电池工作一段时间后碳棒变细 | |
| B. | 氢氧燃料电池可将热能直接转变为电能 | |
| C. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| D. | 氢氧燃料电池工作时氢气在负极被氧化 |
分析 A、根据锌锰干电池的正极是碳棒,该极上二氧化锰发生得电子的还原反应;
B、氢氧燃料电池是将化学能转化为电能的装置;
C、太阳能电池的主要材料是半导体硅;
D、氢氧燃料电池中,燃料做负极发生失电子的氧化反应.
解答 解:A、在锌锰干电池中,正极是碳棒,该极上二氧化锰发生得电子的还原反应,该电极质量不会减少,故A错误;
B、氢氧燃料电池属于原电池的一种,是将化学能转化为电能的装置,不是将热能直接转变为电能,故B错误;
C、太阳能电池的主要材料是半导体硅,不是二氧化硅,故C错误;
D、氢氧燃料电池中,燃料氢气做负极,发生失电子的氧化反应,被氧化,故D正确;
故选D.
点评 本题考查锌锰干电池以及氢氧燃料电池的有关知识,属于基本知识的考查,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列说法中,正确的是( )
| A. | IA和VIIA族元素间可形成共价化合物 | |
| B. | 第二周期:从左到右最高价从+1到+7 | |
| C. | 同主族的单核阴离子:还原性越强,水解程度越大 | |
| D. | 同周期金属:原子失电子能力越强,最高化合价越高 |
12.反应3NO2+H2O=2HNO3+NO中,当有4mol电子发生转移时,被氧化的物质与被还原的物质的物质的量之比是( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 3:1 |
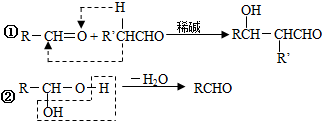
13.卤代烃与金属镁在无水乙醚中反应,可得格氏试剂R-MgX,它可与醛、酮等羰基化合物加成: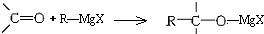 ,所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一.现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是( )
,所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一.现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是( )
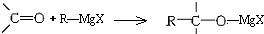 ,所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一.现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是( )
,所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一.现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是( )| A. | 乙醛和氯乙烷 | B. | 甲醛和1-溴丙烷 | C. | 甲醛和2-溴丙烷 | D. | 丙酮和一氯甲烷 |
10.下列实验操作或装置(略去部分夹持仪器)正确的是( )
| A. | 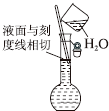 配制溶液 | B. | 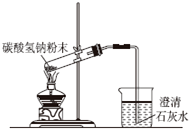 碳酸氢钠受热分解 | ||
| C. | 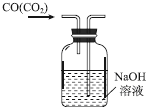 除去CO中的CO2 | D. | 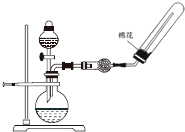 制备收集干燥的氨气 |
17.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O.当产物n(NO2):n(NO)=1:1时,下列说法不正确的是( )
| A. | 反应中Cu2S只做还原剂 | |
| B. | 参加反应的n(Cu2S):n(HNO3)=1:5 | |
| C. | 产物n[Cu(NO3)2]:n[CuSO4]=1:1 | |
| D. | 1 molCu2S参加反应时有10 mol电子转移 |

 ;
; ;Ⅱ、D→E2
;Ⅱ、D→E2 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;
+2H2O;