题目内容
9.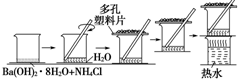 研究化学反应中的能量变化时,在一只小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据下图所示实验步骤进行操作.回答下列问题:
研究化学反应中的能量变化时,在一只小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据下图所示实验步骤进行操作.回答下列问题:(1)写出实验过程中发生反应的化学方程式:Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O.
(2)检验有NH3生成的方法是在烧杯上方放一张湿润的红色石蕊试纸,试纸变蓝,证明有氨气生成(或用蘸有浓盐酸的玻璃棒放在烧杯上方,看到白烟,证明有氨气生成).
(3)反应中产生的NH3会污染环境,对人体有害.为减少其挥发,实验时在烧杯上方盖了一个多孔塑料板,反应后移走多孔塑料板,发现混合物成糊状,证明有水生成.为了更好的解决NH3的污染问题,可以做一个简单的改进,你的改进方法是用浸有稀硫酸的棉花覆盖在多孔塑料片上来吸收产生的NH3(在通风橱中进行等合理答案也行).
分析 (1)反应为复分解反应,二者反应生成氨气、水以及氯化钡;
(2)通常用湿润的红色石蕊试纸或浓盐酸检验氨气,据此写出检验方法;
(3)混合物成糊状,说明反应中生成了水;根据反应中有氨气生成,氨气有毒,会造成环境污染,需要进行尾气处理.
解答 解:(1)氯化铵属于铵盐,能和强碱氢氧化钡反应生成氨气、水及氯化钡,反应的化学方程式为:Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O,
故答案为:Ba(OH)2•8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O;
(2)该实验中检验氨气的方法有:在烧杯上方放一张湿润的红色石蕊试纸,试纸变蓝,证明有氨气生成,或用蘸有浓盐酸的玻璃棒放在烧杯上方,看到白烟,证明有氨气生成,
故答案为:在烧杯上方放一张湿润的红色石蕊试纸,试纸变蓝,证明有氨气生成(或用蘸有浓盐酸的玻璃棒放在烧杯上方,看到白烟,证明有氨气生成);
(3)反应后移走多孔塑料片观察反应物,混合物成糊状,说明反应中生成了水;
由于反应过程中产生对人体有害的气体氨气,氨气会对环境造成污染,所以应用浸有稀H2SO4的棉花覆盖在多孔塑料片上来吸收产生的氨气,
故答案为:水;用浸有稀硫酸的棉花覆盖在多孔塑料片上来吸收产生的NH3(在通风橱中进行等合理答案也行).
点评 本题考查了探究化学反应与能量变化的关系,题目难度中等,注意掌握化学反应与能量变化的关系,明确探究吸热反应、放热反应的方法,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
19.下列说法正确的是( )
| A. | 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小 | |
| B. | 乙烯与溴发生加成反应的产物为溴乙烷 | |
| C. | 1 mol 苯恰好与3 mol氢气完全加成,说明一个苯分子中有三个碳碳双键 | |
| D. | n=7,主链上有5个碳原子烷烃共有五种 |
20.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
17.几种短周期元素的原子半径及主要化合价如下表:
下列说法正确的是( )
| 元素代号 | X | Y | Z | M | N | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 1.02 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +6 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -2 | -3 | -2 | |
| A. | 气态氢化物的稳定性:N>Y | |
| B. | M(OH)2的碱性比XOH的碱性强 | |
| C. | 元素X和Q形成的化合物只可能有离子键 | |
| D. | X、Z、N的最高价氧化物对应的水化物之间可两两相互反应 |
4. 某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )
某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )
 某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )
某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )| A. | 工作时电极b作正极,O2-由电极b流向电极a | |
| B. | 负极的电极反应式为:CO+O2--2e-═CO2 | |
| C. | 当传感器中通过2×10-3 mol电子时,通过的尾气中含有2.24 mL CO | |
| D. | 传感器中通过的电流越大,尾气中CO的含量越高 |
14.草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO4-+H2C2O4+H+--Mn2++CO2↑+H2O(未配平)
用4mL 0.001mol•L-1KMnO4溶液与2mL 0.01mol•L-1 H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:回答下列问题:
(1)该反应中氧化剂和还原剂的物质的量之比为2:5.
(2)如果研究浓度对化学反应速率的影响,应使用实验I和IV(用Ⅰ~Ⅳ表示,下同),实验Ⅳ中加入1mL蒸馏水的目的是确保I和IV组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变.
(3)如果研究温度对化学反应速率的影响,应使用实验I和III.
(4)研究发现,在反应开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.在排除温度的影响后,你猜想还可能是催化剂(或锰离子的催化作用)的影响.为了验证这种猜想,某同学在实验Ⅱ中加入X溶液进行验证,则X可能是B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
MnO4-+H2C2O4+H+--Mn2++CO2↑+H2O(未配平)
用4mL 0.001mol•L-1KMnO4溶液与2mL 0.01mol•L-1 H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:回答下列问题:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和X溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(2)如果研究浓度对化学反应速率的影响,应使用实验I和IV(用Ⅰ~Ⅳ表示,下同),实验Ⅳ中加入1mL蒸馏水的目的是确保I和IV组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变.
(3)如果研究温度对化学反应速率的影响,应使用实验I和III.
(4)研究发现,在反应开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.在排除温度的影响后,你猜想还可能是催化剂(或锰离子的催化作用)的影响.为了验证这种猜想,某同学在实验Ⅱ中加入X溶液进行验证,则X可能是B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
1.酒石酸是葡萄酒中特有的一种有机酸,葡萄酒的pH主要取决于酒石酸的含量,正常的葡萄酒pH约为2.9~3.8.常温下,酒石酸(用H2T表示)水溶液中三种微粒所占的分数(a)与pH的关系如图所示.下列表述不正确的是( )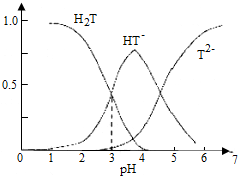

| A. | 葡萄酒中除了存在酒石酸外,还存在酒石酸盐 | |
| B. | 常温下,H2T?H++HT- Ka=10-3 | |
| C. | 当葡萄酒的pH为3.7时,HT-所占分数达到最大,此时葡萄酒中H2T>T2- | |
| D. | 当HT-和T2-物质的量浓度相等时,溶液中水电离出来的氢离子浓度小于纯水中氢离子的浓度 |
12.下列有关叙述中,正确的是( )
| A. | 在一定温度下的BaSO4水溶液中,Ba2+和SO42-浓度的乘积是一个常数 | |
| B. | 向含有BaSO4固体的溶液中加入适量的水使溶解又达到平衡时,BaSO4的溶度积不变,其溶解度也不变 | |
| C. | 只有难溶电解质才存在沉淀溶解平衡过程 | |
| D. | 向饱和的BaSO4水溶液中加入硫酸,BaSO4的Ksp变大 |