题目内容
4. 某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )
某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )| A. | 工作时电极b作正极,O2-由电极b流向电极a | |
| B. | 负极的电极反应式为:CO+O2--2e-═CO2 | |
| C. | 当传感器中通过2×10-3 mol电子时,通过的尾气中含有2.24 mL CO | |
| D. | 传感器中通过的电流越大,尾气中CO的含量越高 |
分析 该装置是原电池,负极上一氧化碳失电子发生氧化反应,电极反应式为CO-2e-+O2-═CO2,正极上氧气得电子发生还原反应,原电池放电时电子从负极流向正极,阴离子向负极移动,一氧化碳的含量越大,原电池放电时产生的电流越大.
解答 解:A.工作时电极b作正极,阴离子向负极移动,O2-由电极b流向电极a,故A正确;
B.负极上一氧化碳失电子发生氧化反应,电极反应式为CO-2e-+O2-═CO2,故B正确;
C.如是标准状况下,传感器中测得有2×10-3mol电子通过时,反应的CO为22.4mL CO,但尾气不一定完全反应,体积一般大于22.4mL,故C错误;
D.一氧化碳的含量越大,原电池放电时产生的电流越大,故D正确.
故选C.
点评 本题是对CO-O2型燃料电池原理的考查,根据原电池正负极上得失电子及反应类型、离子的移动方向等来分析解答,难度不大.

练习册系列答案
相关题目
12.下列有关元素化合物的说法正确的是( )
| A. | 常温下,1mol铜片投入含有4mol HNO3的浓硝酸中,铜片可以完全溶解 | |
| B. | Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3 | |
| C. | 电解AlCl3、FeCl3、CuCl2的混合溶液中,阴极上依次析出Cu、Fe、Al | |
| D. | 反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,FeS2中的硫元素全部被氧化 |
19.下列各项中表达正确的是( )
①水分子球棍模型:
②玛瑙的主要成分为硅酸盐
③ 的名称是3-甲基-1-丁醇
的名称是3-甲基-1-丁醇
④聚乙烯单体结构简式为CH2=CH2
⑤HClO的结构简式为:H-Cl-O
⑥16O2与18O2互为同位素.
①水分子球棍模型:

②玛瑙的主要成分为硅酸盐
③
 的名称是3-甲基-1-丁醇
的名称是3-甲基-1-丁醇④聚乙烯单体结构简式为CH2=CH2
⑤HClO的结构简式为:H-Cl-O
⑥16O2与18O2互为同位素.
| A. | ①③④ | B. | ①⑤⑥ | C. | ③④ | D. | ④⑥ |
8.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 锌粒与稀硫酸的反应 | |
| B. | 灼热的氧化铜与CO的反应 | |
| C. | 甲烷在空气中燃烧的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
 .
. .
.
 .
.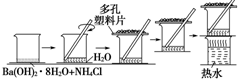 研究化学反应中的能量变化时,在一只小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据下图所示实验步骤进行操作.回答下列问题:
研究化学反应中的能量变化时,在一只小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据下图所示实验步骤进行操作.回答下列问题: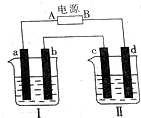 如图所示装置中,烧杯Ⅰ、Ⅱ中分别盛有200g 9.4%的Cu(NO3)2溶液和足量的饱和K2SO3溶液,所用电极均为惰性电极,请回答下列问题:
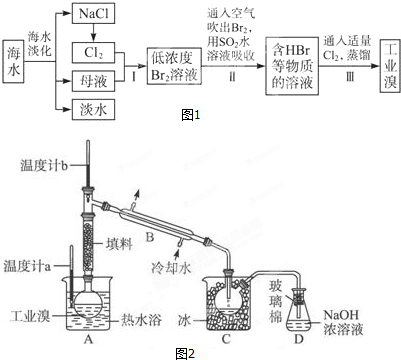
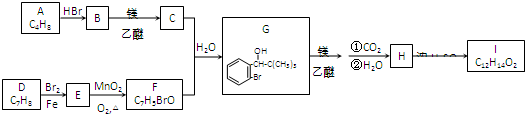
如图所示装置中,烧杯Ⅰ、Ⅱ中分别盛有200g 9.4%的Cu(NO3)2溶液和足量的饱和K2SO3溶液,所用电极均为惰性电极,请回答下列问题: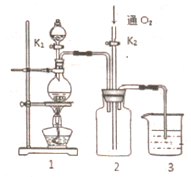 硫酸铜是一种应用极其广泛的化工原料,铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)
硫酸铜是一种应用极其广泛的化工原料,铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)