题目内容
12.下列有关叙述中,正确的是( )| A. | 在一定温度下的BaSO4水溶液中,Ba2+和SO42-浓度的乘积是一个常数 | |
| B. | 向含有BaSO4固体的溶液中加入适量的水使溶解又达到平衡时,BaSO4的溶度积不变,其溶解度也不变 | |
| C. | 只有难溶电解质才存在沉淀溶解平衡过程 | |
| D. | 向饱和的BaSO4水溶液中加入硫酸,BaSO4的Ksp变大 |
分析 A.一定温度下,硫酸钡的溶度积常数是定值,但Ba2+和SO42-浓度的乘积不是定值;
B.溶度积常数、溶解度都与温度有关;
C.任何电解质都存在沉淀溶解平衡;
D.溶度积常数只与温度有关.
解答 解:A.一定温度下,硫酸钡的溶度积常数是定值,但Ba2+和SO42-浓度的乘积不是定值,可能等于或小于溶度积常数,故A错误;
B.溶度积常数、溶解度都与温度有关,温度不变溶度积常数及溶解度都不变,所以向含有BaSO4固体的溶液中加入适量的水使溶解又达到平衡时,温度不变,则BaSO4的溶度积不变、其溶解度也不变,故B正确;
C.任何电解质都存在沉淀溶解平衡,只要电解质在溶液中溶解的速率等于结晶的速率就达到了沉淀溶解平衡状态,故C错误;
D.溶度积常数只与温度有关,向饱和的BaSO4水溶液中加入硫酸,硫酸根离子浓度增大抑制硫酸钡溶解,温度不变则BaSO4的Ksp不变,故D错误;
故选B.
点评 本题考查溶度积常数影响因素,化学平衡常数、电离平衡常数、盐类水解平衡常数、溶度积常数等都只与温度有关,与物质浓度无关,易错选项是AC.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
8.已知2SO2(g)+O2(g)?2SO3(g).若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法不正确的是( )
| A. | 升高温度,可以加快反应速率 | |
| B. | 使用催化剂是为了加快反应速率 | |
| C. | 在上述条件下,SO2不能完全转化为SO3 | |
| D. | 达到平衡时,SO2的浓度与SO3的浓度一定相等 |
6.25℃时,H2SO3及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )
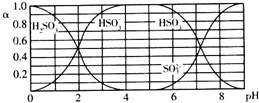

| A. | 溶液的pH=5时,硫元素的主要存在形式为HSO3- | |
| B. | 当溶液恰好呈中性时:c(Na+)>c(SO32-)+c(HSO3-) | |
| C. | 向pH=8的上述溶液中滴加少量澄清石灰水,c(HSO−3)c(SO2−3)的值增大 | |
| D. | 向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3-)减小 |
17.如图是某化学兴趣小组制备PCl3的实验装置(部分仪器已省略):

有关物质的部分性质如下:
请回答下列问题:
(1)仪器戊的名称为冷凝管.
(2)实验时甲中所发生反应的化学方程式为MnO2+4HCl(浓)△_MnCl2+Cl2↑+2H2O.
(3)乙中盛放的试剂是饱和氯化钠溶液,其作用是除去氯气中的氯化氢;丙中盛放的试剂是浓硫酸,其作用是除去氯气中的水蒸气.
(4)向仪器丁中通入干燥、纯净的Cl2之前,应先通入一段时间的CO2,其目的主要是排净装置中的空气,防止空气中的水分和氧气与PCl3反应.
(5)碱石灰的作用是吸收多余的Cl2,防止污染环境;防止空气中的水蒸气进入影响产品纯度(答出一条即可).
(6)PCl3粗产品中常含有POCl3、PCl5等,加入黄磷(化学式用P表示)经加热除去PCl5的化学反应方程式为3PCl5+2P△_5PCl3,后通过蒸馏(填实验操作名称),即可得到PCl3纯品.

有关物质的部分性质如下:
| 熔点/℃ | 沸点/℃ | 其他 | |
| 黄磷 | 44.1 | 280.5 | 2P(过量)+3Cl2△_2PCl3;2P+5Cl2(过量)△_2PCl5 |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
(1)仪器戊的名称为冷凝管.
(2)实验时甲中所发生反应的化学方程式为MnO2+4HCl(浓)△_MnCl2+Cl2↑+2H2O.
(3)乙中盛放的试剂是饱和氯化钠溶液,其作用是除去氯气中的氯化氢;丙中盛放的试剂是浓硫酸,其作用是除去氯气中的水蒸气.
(4)向仪器丁中通入干燥、纯净的Cl2之前,应先通入一段时间的CO2,其目的主要是排净装置中的空气,防止空气中的水分和氧气与PCl3反应.
(5)碱石灰的作用是吸收多余的Cl2,防止污染环境;防止空气中的水蒸气进入影响产品纯度(答出一条即可).
(6)PCl3粗产品中常含有POCl3、PCl5等,加入黄磷(化学式用P表示)经加热除去PCl5的化学反应方程式为3PCl5+2P△_5PCl3,后通过蒸馏(填实验操作名称),即可得到PCl3纯品.
4.下列图示试验正确的是( )
| A. |  制取收集干燥氨气 | B. |  碳酸氢钠受热分解 | ||
| C. |  除去CO气体中的CO2气体 | D. | 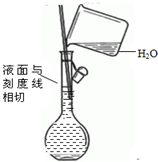 配制溶液 |
1.下列烃中,一卤代物的同分异构体的数目最少和最多的分别是( )
| A. | 乙烷 | B. | 2-甲基丙烷 | C. | 2,2-二甲基丙烷 | D. | 2,2-二甲基丁烷 |
2.A、B是短周期元素,两元素能形成B2A型离子化合物,B离子比A离子少一个电子层,已知A的原子序数为n,则B的原子序数为( )
| A. | n-5 | B. | n+3 | C. | n+13 | D. | n-13 |
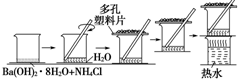 研究化学反应中的能量变化时,在一只小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据下图所示实验步骤进行操作.回答下列问题:
研究化学反应中的能量变化时,在一只小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据下图所示实验步骤进行操作.回答下列问题: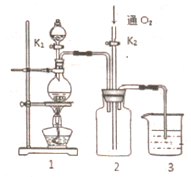 硫酸铜是一种应用极其广泛的化工原料,铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)
硫酸铜是一种应用极其广泛的化工原料,铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)