题目内容
3.下列溶液中,粒子的物质的量浓度关系正确的是( )| A. | 0.1mol•L-1Na2SO3溶液中:c(OH-)=c(HSO3-)+c(H+)+c(H2SO3) | |
| B. | 1L0.1mol•L-1CuCl2溶液中:c(Cl-)=2c(Cu2+) | |
| C. | 物质的量浓度相等的Na2S和NaHS的混合溶液中:2c(Na+)=3c(S2-)+3c(HS-)+3c(H2S) | |
| D. | 室温时,向一定物质的量浓度的CH3COOH溶液中加入一定体积的氢氧化钠溶液,充分反应后溶液的pH=7,则反应后的溶液中:c(CH3COO-)>c(Na+)>c(H+)=c(OH-) |
分析 A.根据亚硫酸钠溶液中的质子守恒分析;
B.铜离子部分水解,导致铜离子数目减少;
C.根据混合液中的物料守恒分析;
D.溶液的pH=7,则c(H+)=c(OH-),结合电荷守恒可知c(CH3COO-)=c(Na+).
解答 解:A.0.1mol•L-1Na2SO3溶液中,根据质子守恒可得:c(OH-)=c(HSO3-)+c(H+)+2c(H2SO3),故A错误;
B.1L0.1mol•L-1CuCl2溶液中,由于铜离子部分水解,则铜离子的物质的量减少,故c(Cl-)>2c(Cu2+),故B错误;
C.物质的量浓度相等的Na2S和NaHS的混合溶液中,Na元素是S元素的1.5倍,根据物料守恒可得:2c(Na+)=3c(S2-)+3c(HS-)+3c(H2S),故C正确;
D.室温下向一定物质的量浓度的CH3COOH溶液中加入一定体积的氢氧化钠溶液,充分反应后溶液的pH=7,则c(H+)=c(OH-),结合电荷守恒可知c(CH3COO-)=c(Na+),则溶液中离子浓度大小为:c(CH3COO-)=c(Na+)>c(H+)=c(OH-),故D错误;
故选C.
点评 本题考查了溶液中离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒、质子守恒的含义及应用方法为解答关键,注意掌握盐的水解原理,明确判断离子浓度大小常用方法.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
13.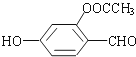 已知醛基能发生如下反应:2-CHO+OH-→CH2OH+COO-.则1mol如图所示的有机物与足量的NaOH溶液作用后,最多消耗NaOH的物质的量为( )
已知醛基能发生如下反应:2-CHO+OH-→CH2OH+COO-.则1mol如图所示的有机物与足量的NaOH溶液作用后,最多消耗NaOH的物质的量为( )
 已知醛基能发生如下反应:2-CHO+OH-→CH2OH+COO-.则1mol如图所示的有机物与足量的NaOH溶液作用后,最多消耗NaOH的物质的量为( )
已知醛基能发生如下反应:2-CHO+OH-→CH2OH+COO-.则1mol如图所示的有机物与足量的NaOH溶液作用后,最多消耗NaOH的物质的量为( )| A. | 2.5mol | B. | 3mol | C. | 3.5 mol | D. | 4 mol |
14.下列过程一定发生化学变化的是( )
| A. | 萝卜风干 | B. | 苹果冷藏 | C. | 葡萄酿酒 | D. | 甘蔗榨汁 |
15.下列叙述不正确的是( )
| A. | 有单质生成的分解反应一定是氧化还原反应 | |
| B. | 氧化还原反应的本质是电子的得失或偏移 | |
| C. | 臭氧与氧气结构不同,二者之间的转化是氧化还原反应 | |
| D. | Cl-、I-、S2-等只有还原性,但也有不少阴离子有较强的氧化性 |
12.某元素原子R的原子核外有16个电子,质量数为34,则原子核里的中子数为( )
| A. | 32 | B. | 20 | C. | 16 | D. | 18 |
13.现有含NaCl、Na2SO4 和NaNO3 的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl- 和NO3- 的相互分离.相应的实验过程如下:
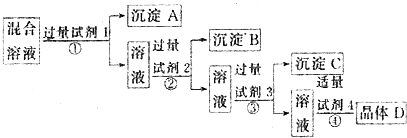
下列关于四种试剂顺序正确的是( )

下列关于四种试剂顺序正确的是( )
| A. | 氯化钡溶液、硝酸银溶液、碳酸钠溶液、硝酸溶液 | |
| B. | 硝酸银溶液、氯化钡溶液、碳酸钠溶液、硝酸溶液 | |
| C. | 氯化钡溶液、硝酸银溶液、硝酸溶液、碳酸钠溶液 | |
| D. | 硝酸银溶液、碳酸钠溶液、氯化钡溶液、硝酸溶液 |
 X、Y、Z、R为短周期元素,原子序数依次增大.X的一种单质是自然界中最硬的物质;Y的单质在空气中含量最高.Z 的氧化物是常见的两性氧化物;R 基态原子最外层成对电子的数目和未成对电子 的数目相等.
X、Y、Z、R为短周期元素,原子序数依次增大.X的一种单质是自然界中最硬的物质;Y的单质在空气中含量最高.Z 的氧化物是常见的两性氧化物;R 基态原子最外层成对电子的数目和未成对电子 的数目相等.