题目内容
8. X、Y、Z、R为短周期元素,原子序数依次增大.X的一种单质是自然界中最硬的物质;Y的单质在空气中含量最高.Z 的氧化物是常见的两性氧化物;R 基态原子最外层成对电子的数目和未成对电子 的数目相等.
X、Y、Z、R为短周期元素,原子序数依次增大.X的一种单质是自然界中最硬的物质;Y的单质在空气中含量最高.Z 的氧化物是常见的两性氧化物;R 基态原子最外层成对电子的数目和未成对电子 的数目相等. (1)R 位于元素周期表第三周期,第ⅣA族.
(2)X、R 元素的最高价氧化物对应的水化物中,酸性较强的是H2CO3. (填化学式)
(3)Y 元素所在周期中,电负性最大的元素是F.
(4)X 和 R 形成的物质是一种超硬材料,其晶胞结构如右图所示,晶胞中 X 原子的个数是4.
(5)X 的单质完全燃烧生成的产物分子中,σ 键与 π 键的数目之比是1:1.
(6)Y 和 Z 所形成的化合物 ZY 难溶于水,但易发生水解.ZY 在 NaOH 溶液中水解的离子方程式是AlN+OH-+H2O=AlO2-+NH3↑.
分析 X、Y、Z、R为短周期元素,原子序数依次增大.X的一种单质是自然界中最硬的物质,则X为C元素;Y的单质在空气中含量最高,则Y为O元素.Z 的氧化物是常见的两性氧化物,则Z为Al;R 基态原子最外层成对电子的数目和未成对电子的数目相等,原子序数大于Al,故其核外电子排布为1s22s22p63s23p2,则R为Si,据此解答.
解答 解:X、Y、Z、R为短周期元素,原子序数依次增大.X的一种单质是自然界中最硬的物质,则X为C元素;Y的单质在空气中含量最高,则Y为O元素.Z 的氧化物是常见的两性氧化物,则Z为Al;R 基态原子最外层成对电子的数目和未成对电子的数目相等,原子序数大于Al,故其核外电子排布为1s22s22p63s23p2,则R为Si.
(1)R为Si元素,原子序数为14,位于周期表中第三周期第ⅣA族,故答案为:三;ⅣA;
(2)X、R分别为C、Si元素,非金属性:C>Si,则元素的最高价氧化物对应的水化物酸性:H2CO3>H2SiO3,故答案为:H2CO3;
(3)Y为N元素,处于第二周期,同周期自左而右电负性增大,F元素电负性最强,故答案为:F;
(4)X和R形成的物质为是一种超硬材料为碳化硅,根据晶胞结构图可知,黑色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,白色球数目为4,则每个晶胞中含有X原子的数目为:4,故答案为:4;
(5)X的单质为碳,碳完全燃烧生成的产物为二氧化碳,其结构式为O=C=O,σ 键与 π 键的数目之比是1:1,故答案为:1:1;
(6)Y和Z所形成的化合物ZY为AlN,氮化铝水解生成氢氧化铝和氨气,则AlN在NaOH溶液中反应生成偏铝酸根离子和氨气,反应的离子方程式为:AlN+OH-+H2O=AlO2-+NH3↑,
故答案为:AlN+OH-+H2O=AlO2-+NH3↑.
点评 本题考查位置结构与性质关系的综合应用,题目难度中等,正确推断各元素为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系.

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案| A. | 二氧化氮中混有一氧化氮杂质,可通入氧气将一氧化氮转化为二氧化氮 | |
| B. | 过量的铜与浓硝酸反应一定有一氧化氮生成 | |
| C. | Fe与S混合加热生成FeS2 | |
| D. | 工业上利用氨气制硝酸属于人工固氮 |
| A. | 它是氧化物 | |
| B. | 含有K、Cr、O三种元素 | |
| C. | 钾、铬、氧三种元素的质量比为 39:52:112 | |
| D. | 重铬酸钾是由2个钾原子、2个铬原子、7个氧原子构成 |
(1)工业上利用CO2和H2反应合成甲醇.已知25℃.101kPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ•mol-1
CH2OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H20(g)△H2=-676kJ•mol-1
①写出CO2和H2反应生成CH2OH(g)与H2O(g)的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50kJ/mol
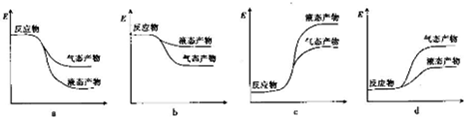
②下列表示该合成甲醇反应的能量变化示意图中正确的是a(填字母)
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)=H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,则达到平衡时H2O的转化率为33.3%
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)=CH2OH(g)△H=-90.1kJ•mol-1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质浓度(mol•L-1)变化如下表所示(前6min没有改变条件)
| 2min | 4min | 6min | 8min | ′′′ | |
| CO | 0.07 | 0.06 | 0.04 | 0.05 | ′′′ |
| H2 | x | 0.12 | 0.12 | 0.2 | ′′′ |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | ′′′ |
②若6~8min时只改变了一个条件,则改变的条件是增加了1 mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性;
Ⅱ温度低,反应速率慢,单位时间内的产量低;而该反应为放热反应,温度过高,转化率降低
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL,0.1000mol•L-1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH>7(填“<”“>”或“=”)原因是HCOO-+H2O?HCOOH+OH-(用离子方程式表示)
| A. | 0.1mol•L-1Na2SO3溶液中:c(OH-)=c(HSO3-)+c(H+)+c(H2SO3) | |
| B. | 1L0.1mol•L-1CuCl2溶液中:c(Cl-)=2c(Cu2+) | |
| C. | 物质的量浓度相等的Na2S和NaHS的混合溶液中:2c(Na+)=3c(S2-)+3c(HS-)+3c(H2S) | |
| D. | 室温时,向一定物质的量浓度的CH3COOH溶液中加入一定体积的氢氧化钠溶液,充分反应后溶液的pH=7,则反应后的溶液中:c(CH3COO-)>c(Na+)>c(H+)=c(OH-) |
| A. | CO32-+2H+═H2O+CO2↑ | B. | CO32-+H+═H2O+CO2↑ | ||
| C. | CO32-+2HCl═2Cl-+H2O+CO2↑ | D. | Na2CO3+2H+═2Na++H2O+CO2↑ |
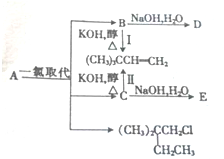 (1)A的分子式为C6H14,1molA完全燃烧消耗O29.5mol.
(1)A的分子式为C6H14,1molA完全燃烧消耗O29.5mol.