题目内容
20.已知反应X(g)+Y(g)?R(g)+Q(g)的平衡常数与温度的关系如表.830℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内${\;}_{v}^{+}$(X)=0.005mol/(L•s).下列说法正确的是( )| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 4 s时容器内c(Y)=0.76 mol/L | |
| B. | 830℃达平衡时,X的转化率为80% | |
| C. | 反应达平衡后,升高温度,平衡正向移动 | |
| D. | 1200℃时反应R(g)+Q(g)?X(g)+Y(g)的平衡常数K=0.4 |
分析 A.反应初始4s内X的平均反应速率v(X)=0.005mol/(L•s),v(Y)=v(X)=0.005mol/(L•s),Y的起始浓度-△c(Y)=4s时c(Y);
B.设平衡时X的浓度变化量为x,利用三段式表示平衡时各组分的平衡浓度,代入平衡常数列方程计算x的值,再根据转化率定义计算;
C.由表格可知,温度升高,化学平衡常数减小,平衡逆向移动;
D.该反应X(g)+Y(g)?R(g)+Q(g)与R(g)+Q(g)?X(g)+Y(g)相反,则平衡常数互为倒数.
解答 解:A.反应初始4s内X的平均反应速率v(X)=0.005mol/(L•s),速率之比等于化学计量数之比,所以v(Y)=v(X)=0.005mol/(L•s),则4s内△c(Y)=0.005mol•L-1•s-1×4s=0.02mol/L,Y的起始浓度为$\frac{0.8mol}{2L}$=0.4mol/L,故4s时c(Y)=0.4mol/L-0.02mol/L=0.38mol/L,故A错误;
B.设平衡时A的浓度变化量为x,则:
X(g)+Y(g)?R(g)+Q(g)
开始(mol/L):0.1 0.4 0 0
变化(mol/L):x x x x
平衡(mol/L):0.1-x 0.4-x x x
故$\frac{{x}^{2}}{(0.1-x)(0.4-x)}$=1,解得x=0.08
所以平衡时X的转化率为$\frac{0.08mol/L}{0.1mol/L}$×100%=80%,故B正确;
C.由表格可知,温度升高,化学平衡常数减小,平衡逆向移动,不是正向移动,故C错误;
D.1200℃时反应X(g)+Y(g)?R(g)+Q(g)的平衡常数值为0.4,所以1200℃时反应R(g)+Q(g)?X(g)+Y(g)的平衡常数的值为$\frac{1}{0.4}$=2.5,故D错误.
故选B.
点评 本题考查化学反应速率、化学平衡常数的计算与运用等,为高考常见题型和高频考点,侧重于学生的分析、计算能力的考查,注意温度不变时,平衡常数不变,化学方程式相反时,平衡常数互为倒数,难度中等.

| 反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H1=-49.01 kJ•mol-1 |
| 反应Ⅱ:2 CH3OH(g)?CH3OCH3(g)+H2O(g) | △H2=-24.52 kJ•mol-1 |
| 反应Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g) | △H3=-5.46 kJ•mol-1 |
| 反应Ⅳ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g) | △H4 |
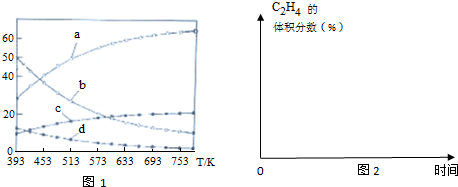
请回答下列问题:
(1)△H4=-128kJ•mol-1
(2)可以判断该反应已经达到平衡的是CE
A.v(CO2)=2v(C2H4)
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.平衡常数K不再改变
E.C2H4的体积分数不再改变
(3)曲线a表示的物质为H2(填化学式),判断依据由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线.
(4)为提高CO2的平衡转化率,可以采取的措施是ABD.
A.降低温度B.分离出H2OC.增加原催化剂的表面积D.增大压强
(5)在图2中,画出393K时体系中C2H4的体积分数随反应时间(从常温进料开始计时)的变化趋势,并标明平衡时C2H4的体积分数数值.
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数 | 1.8×10-4 | 4.9×10-11 | Ki=1.3×10-1 Kr=7.1×10-15 |
| A. | 等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | amol/LHCN与bmol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于或等于b | |
| C. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| D. | 某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |
 如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,电极铝和镁都已除去表面氧化膜.当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,电极铝和镁都已除去表面氧化膜.当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )| A. | 溶液的质量减小程度:乙<甲 | |
| B. | 溶液的导电能力变化:甲>乙 | |
| C. | 甲中阴极和乙中镁电极上析出物质质量:甲=乙 | |
| D. | 电极反应式:甲中阳极:2Cl--2e→Cl2↑,乙中正极:Cu2++2e→Cu |
| A. | 硝酸工业发达 | B. | 雷雨天气多 | C. | 机动车辆过多 | D. | 燃料以煤为主 |
 某化学兴趣小组为探究元索性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元索性质的递变规律,设计了如下系列实验.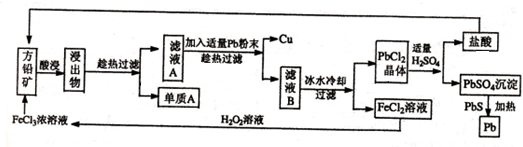
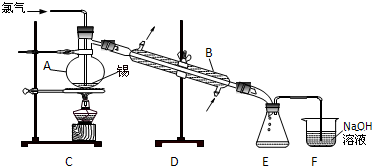 锡有SnCl2、SnCl4两种氯化物.SnCl4是无色液体,极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃.实验室用熔融的金属锡跟干燥的氯气直接作用制取无水SnCl4(此反应过程放出大量的热).实验室制取无水SnCl4的装置如图所示.
锡有SnCl2、SnCl4两种氯化物.SnCl4是无色液体,极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃.实验室用熔融的金属锡跟干燥的氯气直接作用制取无水SnCl4(此反应过程放出大量的热).实验室制取无水SnCl4的装置如图所示.