题目内容
5.X、Y是原子序数大于4的两种主族元素,它们的离子Xm+ 和Yn- 具有相同的核外电子排布.有关X、Y的叙述不正确的是( )| A. | 原子序数大小:X>Y | |
| B. | Xm+ 和Yn- 离子半径大小:r(Yn- )<r(Xm+) | |
| C. | 在周期表中X、Y在不同周期 | |
| D. | 在周期表中X、Y的族序数之差为:8-(m+n) |
分析 X、Y是原子序数大于4的两种主族元素,Xm+和Yn-两种离子的核外电子排布相同,则二者核外电子数相等,X处于Y的下一周期,且X为金属元素,Y为非金属元素.电子层结构相同,核电荷数越大离子半径越小.阳离子电荷数=原子最外层电子数=主族族序数,阴离子所带电荷=族序数-8(H负离子除外),据此解答.
解答 解:A.X、Y是原子序数大于4的两种主族元素,Xm+和Yn-两种离子的核外电子排布相同,则二者核外电子数相等,X处于Y的下一周期,原子序数大小为:X>Y,故A正确;
B.Xm+和Yn-两种离子的核外电子排布相同,X的核电荷数较大,故离子半径Yn->Xm+,故B错误;
C.X处于Y的下一周期,二者不在同一周期,故C正确;
D.X的族序数为m,Y的族序数为8-n,故二者族序数之差为8-n-m=8-(n+m),故D正确,
故选B.
点评 本题原子结构与元素周期律关系,难度不大,根据是根据离子电子层结构相同确定元素在周期表中的相对位置,注意元素周期律的理解掌握.

练习册系列答案
相关题目
15.甲烷和乙烯是两种重要的有机物,关于它们的说法不正确的是( )
| A. | 乙烯是重要的化工原料 | |
| B. | 甲烷和乙烯互为同系物 | |
| C. | 甲烷和乙烯可以用溴水加以鉴别 | |
| D. | 甲烷是最简单的有机物,是天然气的主要成分 |
16.某氢氧燃料电池是用金属铂作电极,以KOH溶液作电解质溶液,从两极分别通入H2和O2.下列对该燃料电池的叙述中正确的是( )
| A. | 负极的电极反应式为:H2-2e-+2OH-═2H2O | |
| B. | H2应从负极通入,发生还原反应 | |
| C. | 标准状况下,通入5.6 L O2并完全反应后,有0.50 mol电子转移 | |
| D. | 放电一段时间后,通入O2的电极附近溶液的pH降低 |
13.同一周期中,X、Y、Z三种元素,其气态氢化物稳定性按X、Y、Z的顺序不断增强,下列说法正确的是( )
| A. | 非金属性X>Y>Z | |
| B. | 原子半径X>Y>Z | |
| C. | 它们最高价氧化物水化物的酸性按X、Y、Z顺序增强 | |
| D. | 气态氢化物的还原性按X、Y、Z顺序增强 |
20.钾的金属活动性比钠强,根本原因是( )
| A. | 钾的密度比钠的小 | B. | 加热时,钾比钠更易气化 | ||
| C. | 钾与水反应比钠与水反应更剧烈 | D. | 钾原子的电子层比钠原子多一层 |
8.研究证明:CO2可作为合成低碳烯烃的原料加以利用,目前利用CO2合成乙烯相关的热化学方程式如下:
反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应Ⅳ,不同温度下平衡时的四种气态物质的量百分数如图1所示:
请回答下列问题:
(1)△H4=-128kJ•mol-1
(2)可以判断该反应已经达到平衡的是CE
A.v(CO2)=2v(C2H4)
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.平衡常数K不再改变
E.C2H4的体积分数不再改变
(3)曲线a表示的物质为H2(填化学式),判断依据由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线.
(4)为提高CO2的平衡转化率,可以采取的措施是ABD.
A.降低温度B.分离出H2OC.增加原催化剂的表面积D.增大压强
(5)在图2中,画出393K时体系中C2H4的体积分数随反应时间(从常温进料开始计时)的变化趋势,并标明平衡时C2H4的体积分数数值.
| 反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H1=-49.01 kJ•mol-1 |
| 反应Ⅱ:2 CH3OH(g)?CH3OCH3(g)+H2O(g) | △H2=-24.52 kJ•mol-1 |
| 反应Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g) | △H3=-5.46 kJ•mol-1 |
| 反应Ⅳ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g) | △H4 |

请回答下列问题:
(1)△H4=-128kJ•mol-1
(2)可以判断该反应已经达到平衡的是CE
A.v(CO2)=2v(C2H4)
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.平衡常数K不再改变
E.C2H4的体积分数不再改变
(3)曲线a表示的物质为H2(填化学式),判断依据由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线.
(4)为提高CO2的平衡转化率,可以采取的措施是ABD.
A.降低温度B.分离出H2OC.增加原催化剂的表面积D.增大压强
(5)在图2中,画出393K时体系中C2H4的体积分数随反应时间(从常温进料开始计时)的变化趋势,并标明平衡时C2H4的体积分数数值.
 ;D、E的最高价氧化物对应水化物发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O; A、C形成的化合物中,C的质量分数最高的化合物的结构式H-O-O-H;A有多种同位素,其中一种同位素原子核内有两个中子,这种同位素原子的符号是31H或T.
;D、E的最高价氧化物对应水化物发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O; A、C形成的化合物中,C的质量分数最高的化合物的结构式H-O-O-H;A有多种同位素,其中一种同位素原子核内有两个中子,这种同位素原子的符号是31H或T. 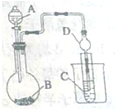 某化学兴趣小组为探究元索性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元索性质的递变规律,设计了如下系列实验.