题目内容
13.原子序数依次增大的A、B、C、D四种元素,B元素的p轨道电子数比s轨道电子数少1,C元素最外层电子数是内层的3倍,D是常见金属元素,其单质与强碱溶液反应可生成A的单质.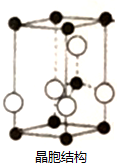
(1)D元素基态原子价电子排布式为3s23p1.
(2)A、C形成的3原子分子X中键角比A、B形成的4原子分子Y中键角大,原因是NH3分子中N原子和H2O中的O原子均是按sp3杂化,N原子有一对孤对电子,而O原子有两对孤对电子,对成键电子的斥力更大,使键角更小.X凝固时体积膨胀,原因是水分子之间含有氢键,水凝固成冰时,水分子排列有序化,体积膨胀,形成的氢键数目增多,在乙醛的X溶液中存在4种类型的氢键.
(3)比较第一电离能大小;B<C;电负性大小:B<C.
(4)在一定条件下C、D的化合物与B单质和炭单质反应生成M和还原性可燃气体N,M是B、D形成的晶体,熔点较高,晶胞结构如图,生成M的化学方程式为Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.单质Q是N的等电子体,写出Q的电子式
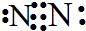 .
.(5)上述M晶体中所含化学键有共价键、配位键,晶胞中深色黑点为N原子,其杂化方式为sp3,若晶胞体积为Vcm3,晶体密度为ρg•cm3,则可求出NA=$\frac{81}{ρV}$.
分析 原子序数依次增大的A、B、C、D四种元素,C元素最外层电子数是内层的3倍,最外层最多含有8个电子,则C只能含有2个电子层,最外层含有6个电子,其原子序数为8,故C为O元素;D是常见金属元素,其单质与强碱溶液反应可生成A的单质,该单质为氢气,则D为Al元素,A为H元素;B元素的p轨道电子数比s轨道电子数少1,B的原子序数小于C(O元素),则B含有2个电子层,s轨道的总电子数为4,p轨道的总电子数为3,B原子核外电子排布为1s22s22p3,故B的原子序数为7,是N元素,据此进行解答.
解答 解:C元素最外层电子数是内层的3倍,最外层最多含有8个电子,则C只能含有2个电子层,最外层含有6个电子,其原子序数为8,故C为O元素;D是常见金属元素,其单质与强碱溶液反应可生成A的单质,该单质为氢气,则D为Al元素,A为H元素;B元素的p轨道电子数比s轨道电子数少1,B的原子序数小于C(O元素),则B含有2个电子层,s轨道的总电子数为4,p轨道的总电子数为3,B原子核外电子排布为1s22s22p3,故B的原子序数为7,是N元素,
(1)D为Al元素,Al元素基态原子最外层含有3个电子,其价电子排布式为3s23p1,
故答案为:3s23p1;
(2)A、C形成的3原子分子X为水分子,A、B形成的4原子分子Y氨气,根据杂化轨道理论可知NH3分子中N原子和H2O中的O原子均是按sp3杂化,但氨分子中只有一对孤电子对,而水分子中有两对孤电子对,根据价层电子对互斥理论,水中氧原子中的了两对孤电子对对成键电子的斥力更大,所以NH3分子中键角大于H2O中的键角;
由于水分子之间含有氢键,水凝固成冰时,水分子排列有序化,形成的氢键数目增多,体积膨胀;
乙醛分子之间存在氢键,乙醛中氧元素与水分子的H原子、水的O原子与乙醛的H、水与水之间形成的氢键,所以总共含有4种氢键,
故答案为:NH3分子中N原子和H2O中的O原子均是按sp3杂化,N原子有一对孤对电子,而O原子有两对孤对电子,对成键电子的斥力更大,使键角更小;水分子之间含有氢键,水凝固成冰时,水分子排列有序化,体积膨胀,形成的氢键数目增多;4;
(3)由于N原子的2p轨道处于半满状态,比较稳定,则第一电离能较大,则第一电离能大小为;B<C;同周期元素从左到右,电负性逐渐增强,电负性大小:B<C,
故答案为:<;<;
(4)在一定条件下C、D的化合物为氧化铝,B单质为氮气,炭单质反应生成M和还原性可燃气体N为CO,M是B、D形成的晶体,熔点较高,根据晶胞结构图可知,Al和N原子数之比为1:1,则M为AlN,生成AlN的化学方程式为:Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO;单质Q是N的等电子体,N为CO,含有2个原子、14个电子,组成Q的原子含有的电子数为:$\frac{14}{2}$=7,故Q为氮气,氮气分子中含有氮氮三键,则氮气的电子式为: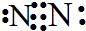 ,
,
故答案为:Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO;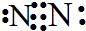 ;
;
(5)上述AlN晶体中所含化学键共价键和配位键,晶胞中深色黑点为N原子,N原子形成3个σ键键和1个配位键,其杂化方式为sp3杂化;
若晶胞体积为Vcm3,晶体密度为ρg•cm3,每个晶胞的质量为:m=ρg•cm3×Vcm3=ρVg,每个晶胞中含有N原子数为:8×$\frac{1}{8}$+1=2,则该晶胞中含有两个AlN分子,故每个晶胞的质量为:$\frac{41}{{N}_{A}}$g×2=ρVg,解得:NA=$\frac{81}{ρV}$,
故答案为:共价键、配位键;sp3;=$\frac{81}{ρV}$.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,推断各元素名称为解答关键,注意熟练掌握常见元素的原子结构与元素周期表、元素周期律的关系,(5)为难点,需要掌握晶胞计算的方法与技巧.

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案| 反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H1=-49.01 kJ•mol-1 |
| 反应Ⅱ:2 CH3OH(g)?CH3OCH3(g)+H2O(g) | △H2=-24.52 kJ•mol-1 |
| 反应Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g) | △H3=-5.46 kJ•mol-1 |
| 反应Ⅳ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g) | △H4 |
请回答下列问题:
(1)△H4=-128kJ•mol-1
(2)可以判断该反应已经达到平衡的是CE
A.v(CO2)=2v(C2H4)
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.平衡常数K不再改变
E.C2H4的体积分数不再改变
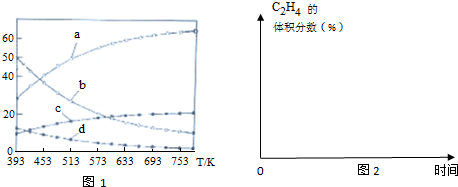
(3)曲线a表示的物质为H2(填化学式),判断依据由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线.
(4)为提高CO2的平衡转化率,可以采取的措施是ABD.
A.降低温度B.分离出H2OC.增加原催化剂的表面积D.增大压强
(5)在图2中,画出393K时体系中C2H4的体积分数随反应时间(从常温进料开始计时)的变化趋势,并标明平衡时C2H4的体积分数数值.
| A. | 温度升高,c(H2PO4-)增大 | |
| B. | 加水稀释后,m(H+)与m(OH-)的乘积减少 | |
| C. | c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-) | |
| D. | c(Na+)=c(H2PO4-)+c(HPO42-)+C(H3PO4) |
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数 | 1.8×10-4 | 4.9×10-11 | Ki=1.3×10-1 Kr=7.1×10-15 |
| A. | 等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | amol/LHCN与bmol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于或等于b | |
| C. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| D. | 某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |
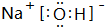 ;D、E的最高价氧化物对应水化物发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O; A、C形成的化合物中,C的质量分数最高的化合物的结构式H-O-O-H;A有多种同位素,其中一种同位素原子核内有两个中子,这种同位素原子的符号是31H或T.
;D、E的最高价氧化物对应水化物发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O; A、C形成的化合物中,C的质量分数最高的化合物的结构式H-O-O-H;A有多种同位素,其中一种同位素原子核内有两个中子,这种同位素原子的符号是31H或T.  异构化可得到三元乙丙橡胶的第三单体
异构化可得到三元乙丙橡胶的第三单体 .
.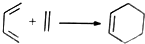 .
.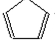 .
.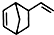 互为同分异构体,且一溴代物只有两种的芳香烃的名称:1,3,5-三甲基苯;写出生成这两种一溴代物所需要的反应试剂和反应条件:催化剂和液溴、光照和溴蒸气.
互为同分异构体,且一溴代物只有两种的芳香烃的名称:1,3,5-三甲基苯;写出生成这两种一溴代物所需要的反应试剂和反应条件:催化剂和液溴、光照和溴蒸气.

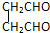
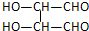
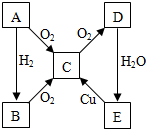 A、B、C、D、E各物质的转化关系如图所示.
A、B、C、D、E各物质的转化关系如图所示.