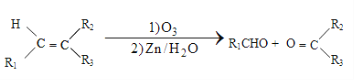题目内容
【题目】[化学一选修3: 物质结构与性质] 钾、碘、铁元素对人体的健康起到至关重要的作用,回答下列问题:
(1)基态K 原子核外有______种不同运动状态的电子,有_____种不同形状的电子云,价电子排布式是__________________。
(2)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于____晶体。
(3)赤铁盐(K3[Fe(CN)6])主要用于制药、电镀等工业,其煅烧分解生成KCN、(CN)2等物质。
①(CN)2中存在碳碳键,则分子中含有___个σ键,___个π键。
②KCN与盐酸作用产生HCN,则HCN中心原子C的杂化轨道类型__________________。
(4)KIO3晶体是一种性能良好的非线型光学材料,具有钙钛矿型的立体结构。
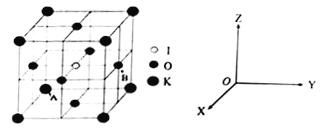
①已知A离子坐标参数为(0,0,0),则B离子的坐标参数________________。
②若KIO3晶胞参数为a纳米(nm)、阿伏伽德罗常数为NA,则该晶体密度为_____g·cm-3(列出计算式即可)。
③若碘原子处在各顶点位置,则钾离子和氧原子在晶胞中的位置分别是_______、___________。
【答案】 19 2 4s1 分子 3 4 sp ![]()
![]() 体心 棱(心)
体心 棱(心)
【解析】试题分析:(1)原子核外有几个电子就有几种运动状态;S、P能级电子云形状不同;钾原子第四层上的电子是价电子;(2)根据Fe(CO)5的熔、沸点较低分析;(3) ①(CN)2中存在碳碳键,结构式为![]() ;②HCN分子的结构式是:H-C≡N,HCN分子中含有2个σ键和2个π键,C原子不含孤电子对,所以价层电子对数是2;(4)①根据晶胞结构分析B离子的坐标;②根据均摊原则计算晶胞的摩尔质量,根据
;②HCN分子的结构式是:H-C≡N,HCN分子中含有2个σ键和2个π键,C原子不含孤电子对,所以价层电子对数是2;(4)①根据晶胞结构分析B离子的坐标;②根据均摊原则计算晶胞的摩尔质量,根据![]() 计算密度;③根据晶胞结构分析;
计算密度;③根据晶胞结构分析;
解析:(1) (1)基态K原子核外有19个电子,所以原子核外有19种运动状态的电子;S、P能级电子云形状不同,K原子核外有2种不同形状的电子云;钾原子第四层上的电子是价电子,价电子排布式是4s1;(2) Fe(CO)5的熔、沸点较低,所以Fe(CO)5是分子晶体;(3) ①(CN)2中存在碳碳键,结构式为![]() ,单键是σ键,三键中有1个 σ键和2个π键,所以分子中含有3个σ键,4个π键。②HCN分子的结构式是:H-C≡N,HCN分子中含有2个σ键和2个π键,C原子不含孤电子对,所以价层电子对数是2,中心原子C原子以sp杂化轨道成键;(4)①根据晶胞结构,B离子的坐标是(
,单键是σ键,三键中有1个 σ键和2个π键,所以分子中含有3个σ键,4个π键。②HCN分子的结构式是:H-C≡N,HCN分子中含有2个σ键和2个π键,C原子不含孤电子对,所以价层电子对数是2,中心原子C原子以sp杂化轨道成键;(4)①根据晶胞结构,B离子的坐标是(![]() );②根据均摊原则,晶胞中含I原子数1、含O原子数
);②根据均摊原则,晶胞中含I原子数1、含O原子数![]() 、含钾原子数
、含钾原子数![]() ,所以晶胞的摩尔质量是214g/mol,晶胞参数为a纳米,则晶胞体积是(a
,所以晶胞的摩尔质量是214g/mol,晶胞参数为a纳米,则晶胞体积是(a![]() 1.0×10-7)3cm3,所以密度是
1.0×10-7)3cm3,所以密度是![]() g·cm-3;③根据基本结构,若碘原子处在各顶点位置,则钾离子和氧原子在晶胞中的位置分别是体心、棱。
g·cm-3;③根据基本结构,若碘原子处在各顶点位置,则钾离子和氧原子在晶胞中的位置分别是体心、棱。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是( )
元素代号 | A | B | D | E | X | Y | Z | W |
化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
A. A的单质能将E单质从YE3的溶液中置换出来
B. A、Y、W的离子半径由大到小顺序是A>W>Y
C. X元素的单质不存在同素异形体
D. Z在DB2中燃烧生成两种化合物