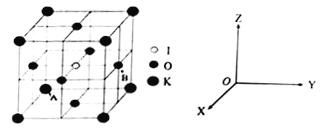
题目内容
【题目】下列的说法,正确的是( )
A. 1 mol FeI2 与足量的氯气反应时转移的电子数为3 NA
B. 12 mol/L的浓硫酸50 ml 与足量的Cu加热反应,得到SO2为0.3 mol
C. 配制一定物质的量浓度溶液时,溶液的体积与容量瓶的量程一致
D. 1 mol NaHSO4固体中含离子总数为4NA
【答案】A
【解析】
A、氯气过量,则Fe2+和I-均能被氧化,每1molFeI2转移3mol电子,即3NA,故A正确。B、Cu与浓硫酸反应的方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,每反应2mol H2SO4得到1mol SO2;若12 mol/L的浓硫酸50 ml含H2SO40.6mol,若反应完全,则产生0.3mol SO2,但是随着反应的进行,浓硫酸变稀,铜与稀硫酸不反应,所以不能产生0.3mol SO2,故B错误;C、容量瓶不是度量工具,没有量程;容量瓶是用来精确配制一定物质的量浓度的溶液的仪器,容量瓶上标有温度、容量规格和一条刻度线, 配制溶液时,溶液的体积要与容量瓶的规格一致,故C错误;D、NaHSO4由Na+和HSO4-组成,1 mol NaHSO4固体中含离子总数为2NA,故D错误。故选A。
CuSO4+SO2↑+2H2O,每反应2mol H2SO4得到1mol SO2;若12 mol/L的浓硫酸50 ml含H2SO40.6mol,若反应完全,则产生0.3mol SO2,但是随着反应的进行,浓硫酸变稀,铜与稀硫酸不反应,所以不能产生0.3mol SO2,故B错误;C、容量瓶不是度量工具,没有量程;容量瓶是用来精确配制一定物质的量浓度的溶液的仪器,容量瓶上标有温度、容量规格和一条刻度线, 配制溶液时,溶液的体积要与容量瓶的规格一致,故C错误;D、NaHSO4由Na+和HSO4-组成,1 mol NaHSO4固体中含离子总数为2NA,故D错误。故选A。

【题目】过氧化钙是一种在水产养殖中广泛使用的供氧剂。某实验研究小组用下图所示的装置制取过氧化钙并测定产品的含量。
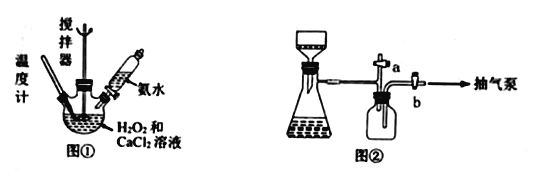
有关过氧化钙的性质如下:
外观与性状 | 溶解性 | 稳定性 | |
过氧化钙(CaO2) | 白色结晶,无臭无味, 有潮解性 | 难溶于水,且不溶于 乙醇、乙醚 | 常温下稳定,加热至 315℃时开始分解 |
回答下列问题:
I.过氧化钙的制备
称取7.5gCaCl2·H2O,用5mL水溶解,加入25mL 30%的H2O2,边搅拌边滴加由5mL 浓NH3·H2O和20mL冷水配成的溶液,保持在0-5℃下充分反应半小时后抽滤,得到粗产品CaO2·8H2O。分别用少量冷水、乙醇洗涤该产品2~3次,在150℃下烘0.5-1h,冷却得到产品无水过氧化钙。
(1)图①盛装“CaCl2和H2O2混合液”的仪器名称______________________________。
(2)写出反应生成CaO2·8H2O的化学方程式___________________________________。
(3)抽滤后得到的晶体依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_________________________。
(4)用图②装置抽滤时,使用抽气泵抽真空前,应先关闭活塞____(填“a”或“b”)。
(5)反应温度以0~5℃为宜的原因____________________________。
II.产品中CaO2含量的测定
准确称取0.15g无水过氧化钙样品于锥形瓶中,加入50mL水和15mL2mol/LHCl,振荡使之溶解,立即用0.02mol/L的KMnO4溶液滴定至溶液呈微红色且半分钟内不褪色为止,重复实验3次,平均消耗20.00mL.KMnO4溶液。
(1)产品中CaO2的质量分数为_______________________________。
(2)若滴定后仰视读数,则测得样品中CaO2的含量___________(填“偏高”“偏低”或“不变”)