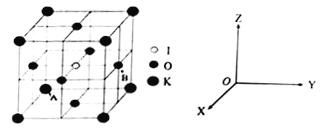
题目内容
【题目】几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是( )
元素代号 | A | B | D | E | X | Y | Z | W |
化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
A. A的单质能将E单质从YE3的溶液中置换出来
B. A、Y、W的离子半径由大到小顺序是A>W>Y
C. X元素的单质不存在同素异形体
D. Z在DB2中燃烧生成两种化合物
【答案】B
【解析】从化合价看,A、E均属于ⅦA,短周期且E的原子半径更大,所以A是F元素,E是Cl元素;B位于ⅥA,原子半径比A略大,应当位于A的左侧,B是O元素;D属于ⅣA,原子半径比B略大,应当位于B的左侧,D是C元素;X位于ⅤA,原子半径比O元素、C元素都大,所以一定不是N元素,则X只能是P元素;X、Y、Z、W原子半径相近属于同一周期,根据它们的化合价推出Y是Al元素、Z是Mg元素、W是Na元素。选项分析:A、A的单质为F2,溶液中F2与H2O直接反应不可能置换出AlCl3中的Cl元素形成Cl2,A错误。B、三种离子分别是F-、Al3+、Na+,它们的电子层数相同,电子排布相同,核电荷数越大半径越小,所以半径顺序为F->Na+>Al3+,B正确。C、X是P元素,白磷、红磷属于同素异形体,C错误。D、该反应为2Mg+CO2![]() 2MgO+C,生成的化合物只有一种,D错误。正确答案B。
2MgO+C,生成的化合物只有一种,D错误。正确答案B。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】过氧化钙是一种在水产养殖中广泛使用的供氧剂。某实验研究小组用下图所示的装置制取过氧化钙并测定产品的含量。
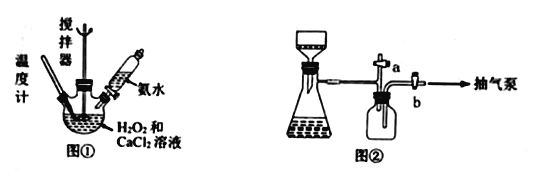
有关过氧化钙的性质如下:
外观与性状 | 溶解性 | 稳定性 | |
过氧化钙(CaO2) | 白色结晶,无臭无味, 有潮解性 | 难溶于水,且不溶于 乙醇、乙醚 | 常温下稳定,加热至 315℃时开始分解 |
回答下列问题:
I.过氧化钙的制备
称取7.5gCaCl2·H2O,用5mL水溶解,加入25mL 30%的H2O2,边搅拌边滴加由5mL 浓NH3·H2O和20mL冷水配成的溶液,保持在0-5℃下充分反应半小时后抽滤,得到粗产品CaO2·8H2O。分别用少量冷水、乙醇洗涤该产品2~3次,在150℃下烘0.5-1h,冷却得到产品无水过氧化钙。
(1)图①盛装“CaCl2和H2O2混合液”的仪器名称______________________________。
(2)写出反应生成CaO2·8H2O的化学方程式___________________________________。
(3)抽滤后得到的晶体依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_________________________。
(4)用图②装置抽滤时,使用抽气泵抽真空前,应先关闭活塞____(填“a”或“b”)。
(5)反应温度以0~5℃为宜的原因____________________________。
II.产品中CaO2含量的测定
准确称取0.15g无水过氧化钙样品于锥形瓶中,加入50mL水和15mL2mol/LHCl,振荡使之溶解,立即用0.02mol/L的KMnO4溶液滴定至溶液呈微红色且半分钟内不褪色为止,重复实验3次,平均消耗20.00mL.KMnO4溶液。
(1)产品中CaO2的质量分数为_______________________________。
(2)若滴定后仰视读数,则测得样品中CaO2的含量___________(填“偏高”“偏低”或“不变”)
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式:_______________________________。
(2)实验结果表明,催化剂的催化效果与________有关。
(3)某同学在10 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是______。

Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如下图所示(A,B,C均为气体,且A气体有颜色)。

(4)该反应的的化学方程式为________________。
(5)反应开始至2分钟时,B的平均反应速率为____。
(6)下列措施能使该反应加快的是__(仅改变一个条件)。
a.降低温度 b.缩小容积c.使用效率更高更合适的催化剂
(7)能说明该反应已达到平衡状态的是___________(填序号)。
①单位时间内生成nmol B的同时生成2nmol C
②单位时间内生成nmol B的同时生成2nmol A
③容器内压强不再随时间而发生变化的状态
④用C、A、B的物质的量浓度变化表示的反应速率的比为2:2:1的状态
⑤混合气体的颜色不再改变的状态
⑥混合气体的密度不再改变的状态
⑦v逆(A)=v正(C)
(8)由图求得平衡时A的转化率为__________。