题目内容
14.H、C、N、O、都属于自然界中常见非金属元素.(1)O、C、N三种元素的第一电离能由小到大顺序是C O N;NH4+中氮原子轨道的杂化类型为sp3杂化.
(2)CO、N2的结构可表示为:C≡O、N≡N两者的键能数据:(单位kJ/mol)
| A-B | A=B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
(3)乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键.
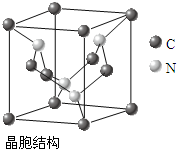
(4)C、N元素形成的新材料具有如右图所示结构,该晶体硬度将超过目前世界上最硬的金刚石,成为首屈一指的超硬新材料.该物质的化学式为:C3N4.
分析 (1)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素;根据价层电子对互斥理论确定其空间构型;
(2)根据断裂三键中的中的一个π键消耗的能量判断;
(3)乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,但三甲胺[N(CH3)3]分子之间不能形成氢键;
(4)利用均摊法确定其化学式.
解答 解:(1)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能由大到小的顺序为:N>O>C;
NH4+中氮原子含有4个共价键,所以其轨道的杂化类是sp3杂化;
故答案为:N>O>C;sp3杂化;
(2)根据表中数据可知,断裂C≡O中的一个π键消耗的能量是1071.9kJ/mol-798.9kJ/mol=273kJ/mol,断裂N≡N中的一个π键消耗的能量是941.7kJ/mol-418.4kJ/mol=523.3kJ/mol,断裂一个π键CO比N2更容易,所以CO更活泼.
故答案为:CO的第一个π键的键能为273kJ/mol,N2中的第一个π键的键能为523.3kJ/mol,所以CO的第一个键比N2更容易断裂;
(3)乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高.
故答案为:乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;
(4)该晶胞中含有碳原子个数=8×$\frac{1}{8}$+4×$\frac{1}{2}$=3,N原子个数为4,所以其化学式为C3N4,故答案为:C3N4.
点评 本题考查物质与结构知识,涉及化学式的确定、氢键、电离能、原子杂化方式等知识点,这些都是高考热点,利用价层电子对互斥理论来确定微粒的空间构型及原子的杂化方式,难度中等.

| A. | CH3CH2CH2CH2Br和NaCN共热 | |
| B. | CH3CH2CH2CH2Br和NaOH的乙醇溶液共热 | |
| C. | CH3CH2CH2CH2Br和NaOH的水溶液共热 | |
| D. | CH3CH2CH2CH2Br(g)和Br2(g)光照 |
| A. | 总物质的量一定时,任意比混合,生成H2O的物质的量不同 | |
| B. | 总质量一定时,任意比混合,生成H2O的质量相同 | |
| C. | 总物质的量一定时,任意比混合,耗氧量相同 | |
| D. | 总质量一定时,任意比混合,耗氧量相同 |
| A. | 甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 苯与硝酸在一定条件下反应生成硝基苯;乙烯与溴的四氯化碳溶液反应 | |
| C. | 乙烯与水生成乙醇的反应 | |
| D. | 在苯中滴入溴水,水层褪色;乙烯与溴水反应 |
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 乙醇、乙酸和乙酸乙酯不能用饱和Na2CO3溶液鉴别 | |
| C. | 化合物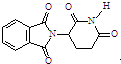 在酸性条件下水解,所得溶液加碱加热后有NH3生成 在酸性条件下水解,所得溶液加碱加热后有NH3生成 | |
| D. | 桶烯(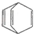 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 |
| A. | 油脂、乙酸乙酯都属于酯类,水解后都会生成乙醇 | |
| B. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
| A. | D2O和H2O | B. | 235U和238U | C. | 红磷和白磷 | D. | SO2和SO3 |
 、
、 、
、 、
、 、
、 .
.