题目内容
17.现有CH4、C2H4、C2H6三种有机物.(1)等质量的以上三种物质完全燃烧时耗O2的量最多的是CH4;生成的CO2的量最多的是C2H4;
(2)同状况,同体积的以上三种物质完全燃烧时消耗的O2的量最多的是C2H6.
(3)在120℃,1.01×105 Pa时,以上有机物中的两种和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是CH4、C2H4.
分析 (1)同质量的烃CxHy,$\frac{y}{x}$值越大,完全燃烧耗氧量越多,生成的H2O物质的量越大,CO2的物质的量越少;
(2)同状况、同体积、同物质的量的烃完全燃烧,耗氧量取决于x+$\frac{y}{4}$的相对大小;
(3)当温度大于100℃时,水为气态,当y=4时,燃烧前后体积不变.
解答 解:(1)同质量的烃CxHy,$\frac{y}{x}$值越大,完全燃烧耗氧量越多,生成的H2O物质的量越大,CO2的物质的量越少,则同质量的CH4、C2H4、C2H6三种有机物中CH4燃烧消耗氧气最多,C2H4生成的二氧化碳最多;
故答案为:CH4;C2H4.
(2)同状况、同体积、同物质的量的烃完全燃烧,耗氧量取决于x+$\frac{y}{4}$的相对大小;
CH4、C2H4、C2H6三种有机物中,x+$\frac{y}{4}$的值分别为2、3、3.5,故同物质的量的以上物质完全燃烧时耗O2的量最多的是C2H6,
故答案为:C2H6;
(3)当温度大于100℃时,水为气态,当y=4时,燃烧前后体积不变,故相同条件下测得反应前后气体体积没有发生变化的是CH4、C2H4,
故答案为:CH4、C2H4.
点评 本题考查烃燃烧烷烃,涉及耗氧量、生成二氧化碳与水的量、体积变化等,难度不大,注意根据燃烧通式进行理解,注意规律的掌握.

练习册系列答案
相关题目
7.近期我国合成多种元素的新同位素,其中一种是${\;}_{72}^{185}$Hf(铪),它的中子数和电子数之差是( )
| A. | 41 | B. | 72 | C. | 113 | D. | 185 |
8.在用RCl2固体配制溶液时,为了得到澄清溶液并防止变质,常向溶液中加入少量R的单质和盐酸.已知R2+有5个电子层,其最外层有2个电子,则下列推断正确的是( )
| A. | R为ⅡA族元素 | B. | R(OH)4是强碱 | ||
| C. | RCl2有还原性,容易被氧化 | D. | R2+的硝酸盐溶液呈中性 |
5.下列反应可以使碳链增长的是( )
| A. | CH3CH2CH2CH2Br和NaCN共热 | |
| B. | CH3CH2CH2CH2Br和NaOH的乙醇溶液共热 | |
| C. | CH3CH2CH2CH2Br和NaOH的水溶液共热 | |
| D. | CH3CH2CH2CH2Br(g)和Br2(g)光照 |
8.某工业含锰酸性废水的主要成分为MnSO4,另外还存在Fe2+、Fe3+、Al3+等离子.现以该废水为原料,制备高纯的碳酸锰,工业流程如下:
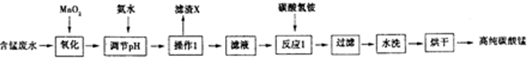
(1)加入MnO2的作用是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O(用离子方程式表示).
(2)下表列出了几种离子生成氢氧化物沉淀时的pH
依据表中数据判断,用氨水调节溶液的pH应至5.2.
(3)滤渣X的主要成分为Fe(OH)3、Al(OH)3,滤液中的溶质为MnSO4、(NH4)2SO4.
(4)已知反应1中会产生一种气体,则该反应的化学方程式为2NH4HCO3+MnSO4=MnCO3+(NH4)2SO4+CO2↑+H2O.
(5)判断水洗步骤中沉淀已洗净的方法是取最后一次的洗涤液于试管中,加入BaCl2溶液和稀硝酸,若无白色沉淀,说明已洗净.
(6)制得的碳酸锰可用于工业上电解法冶炼金属锰.该生产中需先将碳酸锰溶于强酸,配成电解液,写出该反应的离子方程式MnCO3+2H+=Mn2++CO2↑+H2O.

(1)加入MnO2的作用是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O(用离子方程式表示).
(2)下表列出了几种离子生成氢氧化物沉淀时的pH
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Fe3+ | 1.5 | 3.1 |
| Fe2+ | 6.5 | 9.7 |
| Al3+ | 3.3 | 5.2 |
| Mn2+ | 7.8 | 10.4 |
(3)滤渣X的主要成分为Fe(OH)3、Al(OH)3,滤液中的溶质为MnSO4、(NH4)2SO4.
(4)已知反应1中会产生一种气体,则该反应的化学方程式为2NH4HCO3+MnSO4=MnCO3+(NH4)2SO4+CO2↑+H2O.
(5)判断水洗步骤中沉淀已洗净的方法是取最后一次的洗涤液于试管中,加入BaCl2溶液和稀硝酸,若无白色沉淀,说明已洗净.
(6)制得的碳酸锰可用于工业上电解法冶炼金属锰.该生产中需先将碳酸锰溶于强酸,配成电解液,写出该反应的离子方程式MnCO3+2H+=Mn2++CO2↑+H2O.
5.甲苯和甘油组成的混合物在氧气中完全燃烧,下列说法正确的是( )
| A. | 总物质的量一定时,任意比混合,生成H2O的物质的量不同 | |
| B. | 总质量一定时,任意比混合,生成H2O的质量相同 | |
| C. | 总物质的量一定时,任意比混合,耗氧量相同 | |
| D. | 总质量一定时,任意比混合,耗氧量相同 |
6.下列说法正确的是( )
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 乙醇、乙酸和乙酸乙酯不能用饱和Na2CO3溶液鉴别 | |
| C. | 化合物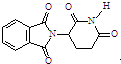 在酸性条件下水解,所得溶液加碱加热后有NH3生成 在酸性条件下水解,所得溶液加碱加热后有NH3生成 | |
| D. | 桶烯(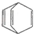 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 |
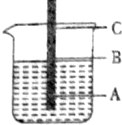 一根铁丝插入煮沸过的蒸馏水中,铁丝上有三点,问:
一根铁丝插入煮沸过的蒸馏水中,铁丝上有三点,问: