题目内容
1.有机合成在现代工、农业生产中占有相当重要的地位,有机物F是一种高分子化合物,可作增塑剂,H是除草剂的中间产物,它们的合成路线如下:已知:
①R1CH=CHR2$\underset{\stackrel{KMn{O}_{4}/{H}^{+}}{→}}{\;}$ R1COOH+R2COOH (R1、R2代表烃基)
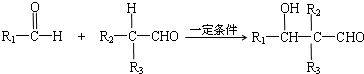
②
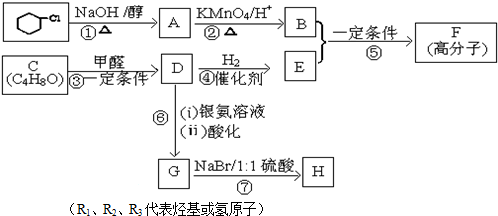
③C核磁共振氢谱图中有3个吸收峰,面积比为 6:1:1.
请回答:
(1)D分子中所含官能团的名称是:羟基、醛基.
(2)写出下列反应的反应类型:反应②氧化反应;反应⑤缩聚反应.
(3)写出由一氯环己烷到A的化学方程式:
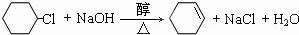 .
.(4)写出满足下列条件所有D的同分异构体的结构简式:HCOOCH2CH2CH2CH3、HCOOCH2CH(CH3)CH3、HCOOCH(CH3)CH2CH3、HCOOC(CH3)3.
①能水解;②与新制氢氧化铜悬浊液加热,产生砖红色沉淀.
(5)G和H的相对分子质量相差63,H能与NaHCO3溶液反应,则0.1moLH与足量NaOH溶液反应,消耗NaOH0.2moL.
(6)写出D物质与新制氢氧化铜的反应的化学方程式:
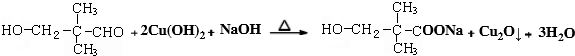
(7)B与E在一定条件下生成F的反应的化学方程式是:
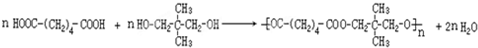 .
.
分析 由转化关系可知,一氯环己烷发生消去反应生成A为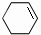 ,结合信息可知,A发生氧化反应生成B为HOOCCH2CH2CH2CH2COOH,C核磁共振氢谱图中有3个吸收峰,面积比为 6:1:1,根据C的分子式可知C为
,结合信息可知,A发生氧化反应生成B为HOOCCH2CH2CH2CH2COOH,C核磁共振氢谱图中有3个吸收峰,面积比为 6:1:1,根据C的分子式可知C为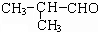 ,结合信息可知C与甲醛发生加成反应生成D为
,结合信息可知C与甲醛发生加成反应生成D为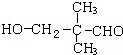 ,D与氢气发生加成反应生成E为
,D与氢气发生加成反应生成E为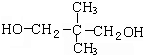 ,B、E发生缩聚反应生成F为
,B、E发生缩聚反应生成F为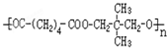 ,D发生银镜反应并酸化生成G为
,D发生银镜反应并酸化生成G为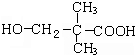 ,G发生取代反应-OH被-Br取代,相对分子质量相差63,则H为
,G发生取代反应-OH被-Br取代,相对分子质量相差63,则H为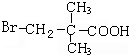 ,据此解答.
,据此解答.
解答 解:由转化关系可知,一氯环己烷发生消去反应生成A为 ,结合信息可知,A发生氧化反应生成B为HOOCCH2CH2CH2CH2COOH,C核磁共振氢谱图中有3个吸收峰,面积比为 6:1:1,根据C的分子式可知C为
,结合信息可知,A发生氧化反应生成B为HOOCCH2CH2CH2CH2COOH,C核磁共振氢谱图中有3个吸收峰,面积比为 6:1:1,根据C的分子式可知C为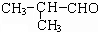 ,结合信息可知C与甲醛发生加成反应生成D为
,结合信息可知C与甲醛发生加成反应生成D为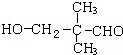 ,D与氢气发生加成反应生成E为
,D与氢气发生加成反应生成E为 ,B、E发生缩聚反应生成F为
,B、E发生缩聚反应生成F为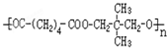 ,D发生银镜反应并酸化生成G为
,D发生银镜反应并酸化生成G为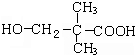 ,G发生取代反应-OH被-Br取代,相对分子质量相差63,则H为
,G发生取代反应-OH被-Br取代,相对分子质量相差63,则H为 ,
,
(1)D为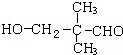 ,含有的官能团为羟基和醛基,
,含有的官能团为羟基和醛基,
故答案为:羟基、醛基;
(2)由上面的分析可知,反应②为氧化反应,反应⑤为缩聚反应,
故答案为:氧化反应;缩聚反应;
(3)一氯环己烷发生消去反应生成A,该反应方程式为: ,
,
故答案为: ;
;
(4)D为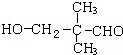 ,其同分异构体①能水解,说明有酯基,②与新制氢氧化铜悬浊液加热,产生砖红色沉淀,说明有醛基,即该结构为甲酸某酯,符合条件的结构简式为:HCOOCH2CH2CH2CH3、HCOOCH2CH(CH3)CH3、HCOOCH(CH3)CH2CH3、HCOOC(CH3)3,
,其同分异构体①能水解,说明有酯基,②与新制氢氧化铜悬浊液加热,产生砖红色沉淀,说明有醛基,即该结构为甲酸某酯,符合条件的结构简式为:HCOOCH2CH2CH2CH3、HCOOCH2CH(CH3)CH3、HCOOCH(CH3)CH2CH3、HCOOC(CH3)3,
故答案为:HCOOCH2CH2CH2CH3、HCOOCH2CH(CH3)CH3、HCOOCH(CH3)CH2CH3、HCOOC(CH3)3;
(5)由上述推断可知,H为 ,-Br和-COOH均与碱反应,则0.1moLH与足量NaOH溶液反应,消耗0.2mol NaOH,
,-Br和-COOH均与碱反应,则0.1moLH与足量NaOH溶液反应,消耗0.2mol NaOH,
故答案为:0.2;
(6)D为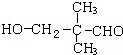 ,D物质与新制氢氧化铜的反应的化学方程式为
,D物质与新制氢氧化铜的反应的化学方程式为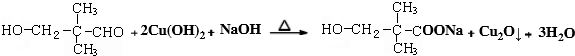 ,
,
故答案为: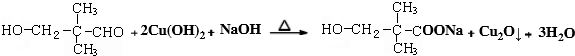 ;
;
(7)B与E在一定条件下生成F的反应为: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成、官能团的结构与性质、同分异构体书写、有机反应方程式书写等,需要学生对给予的信息进行利用,较好的考查学生自学能力、知识迁移运用,注意熟练掌握官能团的性质与转化,题目难度中等.

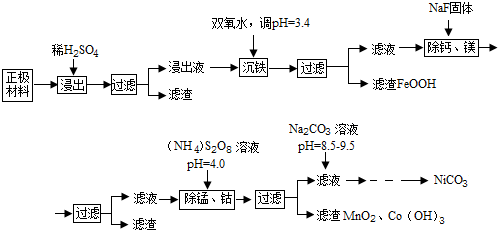
已知:①浸出液中各离子含量
| 金属离子 | Ni2+ | Co2+ | Fe3+ | Mn2+ | Ca2+ | Mg2+ |
| 浓度(g/L) | 63.6 | 5.90 | 1.00 | 0.22 | 5.24×10-2 | 6.37×10-2 |
回答下列问题:
(1)浸出液沉铁过程中,生成的沉淀是FeOOH,发生反应的离子方程式为2Fe2++H2O2+2H2O=2FeOOH+4H+
(2)加入NaF可除去Ca2+、Mg2+,若使溶液中Ca2+、Mg2+浓度小于1.0×10-5mol/L,F浓度必须大于$\sqrt{\frac{6.5×1{0}^{-9}}{1.0×1{0}^{-5}}}$mol/L(列出计算式即可)
(3)过硫酸铵[(NH4)2S2O8除锰的原理是:第一步用过硫酸铵将溶液中的Mn2+氧化成MnO4-,第二步MnO4-继续与Mn2-反应生成MnO2沉淀,在第一步反应中氧化剂和还原剂的物质的量之比为5:2,第二步发生反应的离子方程式为3Mn2++2MnO4-+2H2O=5MnO2↓+4H+,若除去1L浸出液中的Mn2+和Co2+至少需要过硫酸铵13.68g
(4)除锰、钴时若溶液pH较大,会有什么后果?Ni2+也会形成Ni(OH)2沉淀析出
(5)加入Na2CO3溶液后,为得到纯净的NiCO3固体,需要的操作有过滤、洗涤、干燥.
| A. | 在稀硫酸中加人铜粉,铜粉不溶解;再加人NaNO3固体,铜粉仍不溶解 | |
| B. | 向明矾溶液中加人过量NaOH溶液会产生大量白色沉淀 | |
| C. | 除去FeCl3中少量的FeCl2,加人过量稀硝睃 | |
| D. | 浓硫酸、浓硝酸在加热条件下能将木炭氧化为二氧化碳 |
| A. | 锌片溶解65g,铜片上有1molH2生成 | |
| B. | 两极上溶解和析出的物质质量相等 | |
| C. | 锌片每溶解1g,铜片上就析出氢气1g | |
| D. | 锌片溶解1mol,硫酸就消耗1mol |
| A. | 该反应的氧化剂只有CuSO4 | |
| B. | SO42-既不是氧化产物也不是还原产物 | |
| C. | 1mol CuS04 还原了$\frac{1}{4}$mol S | |
| D. | 被还原的S和被氧化的S的质量比为7:3 |
| A. | 阳极反应式相同 | |
| B. | 电解结束后所得液体的pH相同 | |
| C. | 阴极反应式相同 | |
| D. | 通过相同电量时生成的气体总体积相等(同温同压) |

| A. | 该硫酸的物质的量浓度为9.2 mol/L | |
| B. | 1 mol Zn与足量该硫酸反应产生2 g氢气 | |
| C. | 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol/L |
2H2(g)+CO(g)?CH3OH(g)△H1
2CH3OH (g)?CH3OCH3 (g)+H2O(g)△H2
CO(g)+H2O(g)?CO2(g)+H2(g)△H3
则 3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g) 的△H是( )
| A. | △H=2△H1+△H2+△H3 | B. | △H=△H1+△H2+△H3 | ||
| C. | △H=△H1+2△H2+2△H3 | D. | △H=2△H1+△H2-△H3 |

 .
. ,则R有4种.
,则R有4种.