题目内容
15.单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点越高.下列溶液中沸点最高的是( )| A. | 0.01 mol/L的蔗糖溶液 | B. | 0.02 mol/L的CH3COOH溶液 | ||
| C. | 0.02 mol/L的NaCl溶液 | D. | 0.01 mol/L的K2SO4溶液 |
分析 根据溶液中非挥发性溶质的分子或离子数越多,该溶液的沸点就越高,假设溶液为1L,根据n=cV计算选项中溶质含有的粒子的物质的量,物质的量增大的,其沸点最高.
解答 解:A.1L蔗糖溶液中蔗糖的物质的量为:1L×0.01mol/L=0.01mol;
B.CH3COOH是挥发性溶质,且1L溶液中分子的物质的量为:1L×0.02mol/L=0.02mol;
C.1L 0.02mol/LNaCl溶液中溶质的离子的总物质的量为:1L×0.02mol/L×2=0.04mol;
D.1L 0.01mol/L的K2SO4溶液溶质的离子的总物质的量为:1L×0.01mol/L×3=0.03mol;
根据以上分析可知,溶液中溶质的粒子数最多的为C,即C的沸点最高,
故选C.
点评 本题考查物质的量浓度的计算,题目难度中等,试题考查角度新颖,利用非挥发性溶质的分子或离子数来判断溶液的沸点高低,学生熟悉物质的量浓度的有关计算是解答的关键,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
5.在含有Ag+的酸性溶液中,以铁氨矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+.已知:AgSCN(白色s)?Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-?{Fe(SCN)}2+ (红色),K=138.下列说法中不正确的是( )
| A. | 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀 | |
| B. | 当溶液出现红色且半分钟不褪色时即为确定终点 | |
| C. | 上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+ | |
| D. | 滴定时,必须控制溶液的pH,防止Fe3+水解,影响终点的观察. |
6.以石墨为电极分别电解水和饱和食盐水,关于两个电解池反应的说法正确的是( )
| A. | 阳极反应式相同 | |
| B. | 电解结束后所得液体的pH相同 | |
| C. | 阴极反应式相同 | |
| D. | 通过相同电量时生成的气体总体积相等(同温同压) |
3.用下列实验装置室温下进行相应实验,能达到实验目的是( )
| A. | 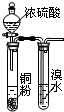 验证浓硫酸具有强氧化性 | B. |  制取干燥的NH3 | ||
| C. |  干燥、收集并吸收多余SO2 | D. | 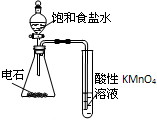 验证乙炔的还原性 |
20.部分弱电解质的电离平衡常数如下表,以下选项错误的是( )
| 化学式 | NH3•H2O | CH3COOH | HCN | H2CO3 |
| Ki(25℃) | 1.8×l0-5 | 1.8×l0-5 | 4.9×l0-10 | Ki1=4.3×l0-7 Ki2=5.6×l0-11 |
| A. | 等物质的量浓度的NaHCO3和NaCN溶液,前者溶液中水的电离程度大 | |
| B. | 0.1 mol/L CH3COONa 溶液显碱性,0.1 mol/L CH3COONH4 溶液显中性 | |
| C. | CN-+H2O+CO2→HCN+HCO3- | |
| D. | 中和等体积、等pH的CH3COOH和HCN消耗NaOH的量前者小于后者 |
7.关于下列各实验装置的叙述中,正确的是( )
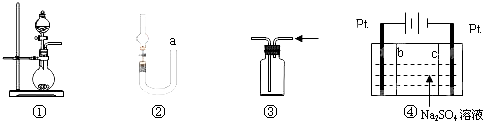

| A. | 图①可用于制取少量NH3或用MnO2和浓盐酸制取Cl2 | |
| B. | 可用从a处加水的方法检验图②装置的气密性 | |
| C. | 实验室可用图③的方法收集Cl2或NH3 | |
| D. | 利用图④装置制硫酸和氢氧化钠,其中c为阴离子交换膜、b为阳离子交换膜 |
9.分子式为C5H10O2,既可与金属反应放出氢气又能发生银镜反应的有机化合物有(不考虑立体异构)( )
| A. | 12种 | B. | 10种 | C. | 8种 | D. | 14种 |

 .
. ,则R有4种.
,则R有4种.