题目内容
16.短周期主族元素X、Y、Z、W在元素周期表中的相对位置如下图所示,已知X的最低负价与Y的最高正价代数和为零,下列说法正确的是( )| X | ||||
| Y | Z | W |
| A. | X分别与Y、Z形成的化合物中化学键类型相同 | |
| B. | Z的最高价氧化物的对应水化物酸性比W的强 | |
| C. | X的简单气态氢化物的稳定性比W的强 | |
| D. | 原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X) |
分析 由短周期主族元素X、Y、Z、W在元素周期表中的相对位置,可知X处于第二周期,Y、Z、W处于第三周期,由位置可知X与Y最外层电子数相差4,设Y的最外层电子数为a,则X最外层电子数为a+4,则Y最高正化合价为+a,X的最低负化合价为(a+4)-8,则X的最低负价与Y的最高正价代数和为零,故a+(a+4)-8=0,解得a=2,可知Y为Mg,则Z为Si、W为P、X为O,以此来解答.
解答 解:由短周期主族元素X、Y、Z、W在元素周期表中的相对位置,可知X处于第二周期,Y、Z、W处于第三周期,由位置可知X与Y最外层电子数相差4,设Y的最外层电子数为a,则X最外层电子数为a+4,则Y最高正化合价为+a,X的最低负化合价为(a+4)-8,则X的最低负价与Y的最高正价代数和为零,故a+(a+4)-8=0,解得a=2,可知Y为Mg,则Z为Si、W为P、X为O,
A.X分别与Y、Z形成的化合物为MgO、SiO2,MgO属于离子化合物,含有离子键,而SiO2属于共价化合物,含有共价键,故A错误;
B.非金属性W>Z,故Z的最高价氧化物的水化物酸性比W的弱,故B错误;
C.非金属性X>W,故X的简单气态氢化物的稳定性比W的强,故C正确;
D.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:r(Y)>r(Z)>r(W)>r(X),故D正确;
故选CD.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素的化合价及最外层电子推断元素为解答的关键,侧重分析、推断及应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.某有机物的结构简式为 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )
 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )| A. | 能与金属钠发生反应并放出氢气 | |
| B. | 能在催化剂作用下与H2发生加成反应 | |
| C. | 不能氧化成醛 | |
| D. | 在浓H2SO4催化下能与乙酸发生酯化反应 |
6.质谱图表明某有机物的相对分子质量为70,红外光谱表征到C=C和C=O的存在,1H核磁共振谱如图(峰面积之比依次为1:1:1:3),下列说法正确的是( )
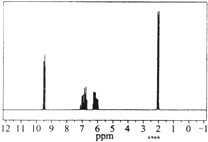

| A. | 分子中共有5种化学环境不同的氢原子 | |
| B. | 该有机物的结构简式为CH3CH=CHCOOH | |
| C. | 该物质的分子式为C4H6O | |
| D. | 该有机物不可能与氢气反应 |
11.镍氢电池的应用很广,其正负极材料都可以再生利用,正极主要为氢氧化镍[Ni(OH)2],其表面覆盖有钴或氢氧化钴[Co(OH)2],还含有Fe、Mn、Ca、Mg等杂质元素,现利用以下工艺流程回收正极材料中的Co、Ni元素(部分条件未给出)
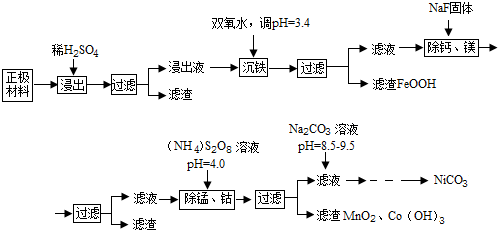
已知:①浸出液中各离子含量
②Ksp(CaF2)=2.7×10-11,Ksp(MgF2)=6.5×10-9,Ksp[Ni(OH)2]=5.5×10-16
回答下列问题:
(1)浸出液沉铁过程中,生成的沉淀是FeOOH,发生反应的离子方程式为2Fe2++H2O2+2H2O=2FeOOH+4H+
(2)加入NaF可除去Ca2+、Mg2+,若使溶液中Ca2+、Mg2+浓度小于1.0×10-5mol/L,F浓度必须大于$\sqrt{\frac{6.5×1{0}^{-9}}{1.0×1{0}^{-5}}}$mol/L(列出计算式即可)
(3)过硫酸铵[(NH4)2S2O8除锰的原理是:第一步用过硫酸铵将溶液中的Mn2+氧化成MnO4-,第二步MnO4-继续与Mn2-反应生成MnO2沉淀,在第一步反应中氧化剂和还原剂的物质的量之比为5:2,第二步发生反应的离子方程式为3Mn2++2MnO4-+2H2O=5MnO2↓+4H+,若除去1L浸出液中的Mn2+和Co2+至少需要过硫酸铵13.68g
(4)除锰、钴时若溶液pH较大,会有什么后果?Ni2+也会形成Ni(OH)2沉淀析出
(5)加入Na2CO3溶液后,为得到纯净的NiCO3固体,需要的操作有过滤、洗涤、干燥.

已知:①浸出液中各离子含量
| 金属离子 | Ni2+ | Co2+ | Fe3+ | Mn2+ | Ca2+ | Mg2+ |
| 浓度(g/L) | 63.6 | 5.90 | 1.00 | 0.22 | 5.24×10-2 | 6.37×10-2 |
回答下列问题:
(1)浸出液沉铁过程中,生成的沉淀是FeOOH,发生反应的离子方程式为2Fe2++H2O2+2H2O=2FeOOH+4H+
(2)加入NaF可除去Ca2+、Mg2+,若使溶液中Ca2+、Mg2+浓度小于1.0×10-5mol/L,F浓度必须大于$\sqrt{\frac{6.5×1{0}^{-9}}{1.0×1{0}^{-5}}}$mol/L(列出计算式即可)
(3)过硫酸铵[(NH4)2S2O8除锰的原理是:第一步用过硫酸铵将溶液中的Mn2+氧化成MnO4-,第二步MnO4-继续与Mn2-反应生成MnO2沉淀,在第一步反应中氧化剂和还原剂的物质的量之比为5:2,第二步发生反应的离子方程式为3Mn2++2MnO4-+2H2O=5MnO2↓+4H+,若除去1L浸出液中的Mn2+和Co2+至少需要过硫酸铵13.68g
(4)除锰、钴时若溶液pH较大,会有什么后果?Ni2+也会形成Ni(OH)2沉淀析出
(5)加入Na2CO3溶液后,为得到纯净的NiCO3固体,需要的操作有过滤、洗涤、干燥.
1.近年来,食品安全事故频繁发生,人们对食品添加剂的认识逐渐加深,Butylated Hydroxy Toluene(简称 BHT)是一种常用的食品抗氧化剂,其合成方法有两种,如图所示:下列说法正确的是( )

| A. |  有五种同分异构体 有五种同分异构体 | B. |  与BHT互为同系物 与BHT互为同系物 | ||
| C. | BHT具有还原性不能发生还原反应 | D. | 两种方法的反应类型都是加成反应 |
8.3-苯基丙酸属于芳香酯的同分异构体共有多少种?( )
| A. | 22 | B. | 23 | C. | 24 | D. | 25 |
5.在含有Ag+的酸性溶液中,以铁氨矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+.已知:AgSCN(白色s)?Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-?{Fe(SCN)}2+ (红色),K=138.下列说法中不正确的是( )
| A. | 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀 | |
| B. | 当溶液出现红色且半分钟不褪色时即为确定终点 | |
| C. | 上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+ | |
| D. | 滴定时,必须控制溶液的pH,防止Fe3+水解,影响终点的观察. |
6.以石墨为电极分别电解水和饱和食盐水,关于两个电解池反应的说法正确的是( )
| A. | 阳极反应式相同 | |
| B. | 电解结束后所得液体的pH相同 | |
| C. | 阴极反应式相同 | |
| D. | 通过相同电量时生成的气体总体积相等(同温同压) |
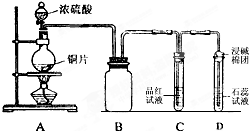 某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验.
某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验. .
.