题目内容
10.下列有关溶液中粒子浓度关系的比较中不正确的是( )| A. | 醋酸溶液中离子浓度的关系满足:c(H+)═c(OH-)+c(CH3COO-) | |
| B. | 用0.100 0 mol•L-1NaOH滴定未知浓度的CH3COOH溶液,恰好反应时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| D. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)═c(Na+) |
分析 A.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.二者恰好中和时生成醋酸钠,醋酸钠是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,再结合电荷守恒判断c(Na+)、c(CH3COO-)相对大小;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.任何电解质溶液中都存在物料守恒,根据物料守恒判断.
解答 解:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得:c(H+)═c(OH-)+c(CH3COO-),故A正确;
B.二者恰好中和时生成醋酸钠,醋酸钠是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,则c(OH-)>c(H+),再结合电荷守恒得c(Na+)>c(CH3COO-),因为盐类水解较微弱,所以离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故B正确;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(M+)═c(OH-)+c(A-),故C正确;
D.任何电解质溶液中都存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)═2c(Na+),故D错误;
故选D.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中的溶质及其性质是解本题关键,再结合电荷守恒、物料守恒来分析解答,注意:溶液中电荷守恒及物料守恒与离子浓度大小无关,与溶液酸碱性无关,为易错点.

练习册系列答案
相关题目
20.晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如图所示,下列说法正确的是( )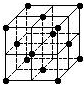

| A. | C60摩尔质量是720 | |
| B. | C60属于离子晶体 | |
| C. | 在C60晶胞中有14个C60分子 | |
| D. | 每个C60分子周围与它距离最近等距离的C60分子有12个 |
1.下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
| A. | 碘与干冰分别受热变为气体 | B. | 硝酸铵与硝酸分别受热变为气体 | ||
| C. | 氯化钠与氯化氢分别溶解在水中 | D. | 氧化铝与冰分别受热熔化 |
5.NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol Fe粉与1mol水蒸气充分反应转移的电子数为3NA | |
| B. | 电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜 | |
| C. | 6.8克熔融的KHSO4混中含有0.1NA个阳离子 | |
| D. | 标准状况下,11.2L四氯化碳所含分子数为0.5NA |
15.下列关于常见有机物的说法错误的是( )
| A. | C5H12属于烷烃且有三种同分异构体 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯是发生取代反应 | |
| C. | 淀粉和纤维素均可用(C6H10O5)n表示,因此它们互为同分异构体 | |
| D. | 乙酸、葡萄糖在一定条件下均能与Cu(OH)2反应 |
2.已知有机物X、Y均具有CH2的最简式,则下列说法中不正确的是( )
| A. | 将X、Y完全燃烧后生成CO2和H2O的物质的量之比均为1:1 | |
| B. | 将等质量的X、Y完全燃烧时消耗O2的量一定相等 | |
| C. | 将等物质的量的X、Y完全燃烧时消耗O2的量一定相等 | |
| D. | 无论X、Y以何种比例混合,只要总质量一定,完全燃烧时消耗的O2的量一定相等 |
19.“绿色化学”是21世纪化学发展的主导方向,下列不符合“化学反应的绿色化学”的是( )
| A. | 消除硫酸厂尾气中的SO2:SO2+2NH3+H2O═(NH4)2SO3 | |
| B. | 消除制硝酸工业尾气中的氢氧化物:NO2+NO+2NaOH═2NaNO2+H2O | |
| C. | 制CuSO4:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O | |
| D. | 制CuSO4:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4(稀)═CuSO4+H2O |
20.下列实验操作、现象和结论正确的是( )


| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②振荡后静止 | 下层液体颜色变浅 | NaOH溶液可除去溶在溴苯中的Br2 |
| C | ③旋开活塞 | 观察到红色喷泉 | NH3极易溶于水,氨水显碱性 |
| D | ④闭合开关K,形成原电池 | Zn极上有红色固体析出 | 锌的金属性比铜强 |
| A. | A | B. | B | C. | C | D. | D |
 A、B、C是单质,其中A是常见的活泼金属,B和C都是无色气体,丁加热后可生成甲.各种物质间的转化关系如图:
A、B、C是单质,其中A是常见的活泼金属,B和C都是无色气体,丁加热后可生成甲.各种物质间的转化关系如图: