题目内容
20.下列实验操作、现象和结论正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②振荡后静止 | 下层液体颜色变浅 | NaOH溶液可除去溶在溴苯中的Br2 |
| C | ③旋开活塞 | 观察到红色喷泉 | NH3极易溶于水,氨水显碱性 |
| D | ④闭合开关K,形成原电池 | Zn极上有红色固体析出 | 锌的金属性比铜强 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯化铵分解生成氯化氢和氨气,温度稍低时又生成氯化铵;
B.溴与氢氧化钠反应生成NaBr和NaBrO;
C.不能形成喷泉;
D.如形成原电池反应,锌应插入硫酸锌溶液,铜插入硫酸铜溶液.
解答 解:A.氯化铵不稳定,加热易分解生成氯化氢和氨气,温度稍低时又生成氯化铵,故A错误;
B.溴与氢氧化钠反应,可用氢氧化钠溶液除杂,故B正确;
C.如氨气不与水接触,圆底烧瓶压强不发生变化,则不能形成喷泉,故C错误;
D.如形成原电池反应,锌应插入硫酸锌溶液,铜插入硫酸铜溶液,否则锌直接置换出铜,则不能形成原电池,故D错误.
故选B.
点评 本题考查较为综合,涉及氯化铵的性质、物质的除杂、喷泉实验以及原电池反应等,为高考常见题型,侧重于学生的分析、实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.

练习册系列答案
相关题目
10.下列有关溶液中粒子浓度关系的比较中不正确的是( )
| A. | 醋酸溶液中离子浓度的关系满足:c(H+)═c(OH-)+c(CH3COO-) | |
| B. | 用0.100 0 mol•L-1NaOH滴定未知浓度的CH3COOH溶液,恰好反应时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| D. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)═c(Na+) |
11.下列热化学方程式或离子方程式中,正确的是( )
| A. | 向溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中,充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)=2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
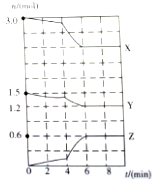
8.已知反应:2NO2(红棕色)?N2O4(无色),分别进行如下两个实验:下列说法不正确的是( )
实验i:将NO2球分别浸泡在热水和冰水中,现象如图1.
实验ii:将一定量的NO2充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)如图2.

实验i:将NO2球分别浸泡在热水和冰水中,现象如图1.
实验ii:将一定量的NO2充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)如图2.

| A. | 图1现象说明该反应为放热反应 | |
| B. | 图2中b点的操作是压缩注射器 | |
| C. | c点:v(正)>v(逆) | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(d)<T(c) |
1.化学与生产、生活、社会密切相关,下列说法正确的是( )
| A. | 今年我国雾霾天气比较严重,雾霾属于气溶胶 | |
| B. | 煤经气化和液化两个物理过程后可变为清洁能源,这是煤综合利用的主要方法 | |
| C. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 | |
| D. | 可以利用盐析和变性来分离、提纯蛋白质 |
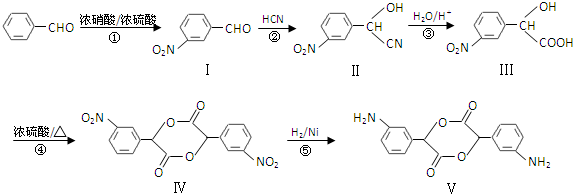
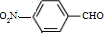 和
和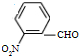 .化合物 I的名称是间硝基苯甲醛.
.化合物 I的名称是间硝基苯甲醛.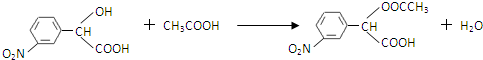 .(不要求写出反应条件)
.(不要求写出反应条件)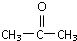 代替化合物 I发生反应②、反应③可以得到化合物Ⅵ(生产有机玻璃的中间体),化合物Ⅵ的结构简式为
代替化合物 I发生反应②、反应③可以得到化合物Ⅵ(生产有机玻璃的中间体),化合物Ⅵ的结构简式为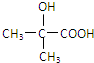 .
.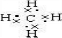 ,食醋中的有机物结构式
,食醋中的有机物结构式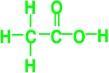 ,糖尿病患者尿液中含的糖类结构简式CH2(OH)CH(OH)CH(OH)CH(OH) CH(OH)CHO.
,糖尿病患者尿液中含的糖类结构简式CH2(OH)CH(OH)CH(OH)CH(OH) CH(OH)CHO.