题目内容
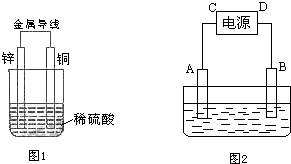
18. A、B、C是单质,其中A是常见的活泼金属,B和C都是无色气体,丁加热后可生成甲.各种物质间的转化关系如图:
A、B、C是单质,其中A是常见的活泼金属,B和C都是无色气体,丁加热后可生成甲.各种物质间的转化关系如图:根据图示转化关系回答:
(1)写出下列物质的化学式.
AAl,BO2,乙NaAlO2,丁Al(OH)3.
(2)写出 ①A与NaOH溶液反应的化学方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
②乙溶液中通入过量CO2反应的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
分析 A、B、C是单质,其中A是常见的活泼金属,B和C都是无色气体,常见金属单质中能与NaOH溶液反应产生气体的只有Al,所以A是Al,乙是NaAlO2,C是H2;甲是Al的化合物,可和NaOH溶液反应产生NaAlO2,可甲能是Al2O3,则丙是H2O,B即是O2,根据NaAlO2+CO2+2H2O═NaHCO3+Al(OH)3↓得丁是Al(OH)3,丁加热后可生成水和氧化铝,符合转化关系.
解答 解:A、B、C是单质,其中A是常见的活泼金属,B和C都是无色气体,常见金属单质中能与NaOH溶液反应产生气体的只有Al,所以A是Al,乙是NaAlO2,C是H2;甲是Al的化合物,可和NaOH溶液反应产生NaAlO2,可甲能是Al2O3,则丙是H2O,B即是O2,根据NaAlO2+CO2+2H2O═NaHCO3+Al(OH)3↓得丁是Al(OH)3,丁加热后可生成水和氧化铝,则:
(1)由上述分析可知,A为Al,B为O2,乙是NaAlO2,丁是Al(OH)3;
故答案为:Al;O2;NaAlO2;Al(OH)3;
(2)①Al与NaOH溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
②乙溶液中通入过量CO2反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
点评 本题以“无机框图题”的形式考查元素单质及其化合物的性质,涉及常用化学用语与氧化还原反应等,难度中等,在熟练掌握元素化合物知识的基础上着重考查学生的发散思维、分析判断、逻辑思维以及对无机物知识的综合应用等能力,Al与碱的特殊的反应是推断的关键.

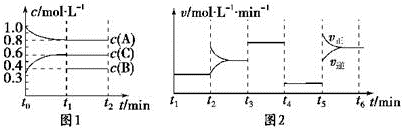
已知t3-t4阶段为使用催化剂;图1中t0-t1阶段c (B)未画出.
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=0.02mol•L-1•min-1.
(2)(2)t4-t5阶段改变的条件为减小压强,B的起始物质的量为1.0mol.各阶段平衡时对应的平衡常如表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
(3)t5-t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:2A(g)+B(g)?3C(g);△H=+200a kJ•mol-1.
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,达到平衡时体系中各物质的量与t1时刻相等,a、b、c要满足的条件为a+$\frac{2}{3}$c=2.4且b+$\frac{1}{3}$c=1.2.
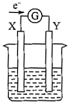 如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )| A. | 外电路的电流方向为:X→外电路→Y | |
| B. | 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn | |
| C. | 若两电极都是金属,则它们的活动性为X>Y | |
| D. | X极上发生的是还原反应,Y极上发生的氧化反应 |
| A. | 饱和碳酸钠溶液 | B. | 浓硫酸 | ||
| C. | 饱和碳酸氢钠溶液 | D. | 饱和石灰水 |
| A. | 醋酸溶液中离子浓度的关系满足:c(H+)═c(OH-)+c(CH3COO-) | |
| B. | 用0.100 0 mol•L-1NaOH滴定未知浓度的CH3COOH溶液,恰好反应时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| D. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)═c(Na+) |
实验i:将NO2球分别浸泡在热水和冰水中,现象如图1.
实验ii:将一定量的NO2充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)如图2.

| A. | 图1现象说明该反应为放热反应 | |
| B. | 图2中b点的操作是压缩注射器 | |
| C. | c点:v(正)>v(逆) | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(d)<T(c) |