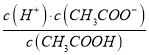题目内容
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示. ![]()
A、C两种元素的原子核外电子数之和等于B原子的质子数,B2﹣的结构示意图为: ![]()
请回答下列问题:
(1)写出A、B、C三种元素的符号:A , B , C .
(2)B位于周期表中第周期族.
(3)C的氢化物的电子式为;A的最高价氧化物对应水化物的化学式为 .
(4)BC6作制冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的制冷剂.已知BC6在温度高于45度时为气态.BC6属于(填“离子”或“共价”)化合物.
【答案】
(1)N;S;F
(2)三;VIA
(3)![]() ;HNO3
;HNO3
(4)共价
【解析】解:A、B、C为短周期元素,根据这几种元素在周期表中的位置知,A和C位于第二周期、B位于第三周期,B2﹣的结构示意图为 ![]() ,第二电子层上最多排列8个电子,所以m=8,B核内质子数=2+8+8﹣2=16,所以B是S元素;A、C两种元素的原子核外电子数之和等于B原子的质子数,结合三种元素的位置知,A是N元素、C是F元素,(1)通过以上分析知,A为N,B为S,C为F,所以答案是:N;S;F;(2)B为S元素,S原子核外有3个电子层、最外层电子数是6,所以B位于周期表中第三周期VIA族,所以答案是:三;VIA;(3)C为F,C的氢化物的电子式为
,第二电子层上最多排列8个电子,所以m=8,B核内质子数=2+8+8﹣2=16,所以B是S元素;A、C两种元素的原子核外电子数之和等于B原子的质子数,结合三种元素的位置知,A是N元素、C是F元素,(1)通过以上分析知,A为N,B为S,C为F,所以答案是:N;S;F;(2)B为S元素,S原子核外有3个电子层、最外层电子数是6,所以B位于周期表中第三周期VIA族,所以答案是:三;VIA;(3)C为F,C的氢化物的电子式为 ![]() ,A的最高价氧化物对应水化物是硝酸,其化学式为HNO3 , 所以答案是:
,A的最高价氧化物对应水化物是硝酸,其化学式为HNO3 , 所以答案是: ![]() ;HNO3;(4)B为S,C为F,已知SF6在温度高于45度时为气态,SF6属于共价化合物, 所以答案是:共价.
;HNO3;(4)B为S,C为F,已知SF6在温度高于45度时为气态,SF6属于共价化合物, 所以答案是:共价.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案
相关题目