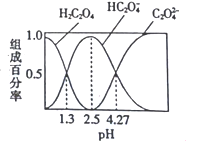
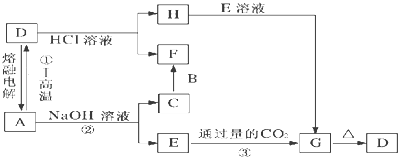
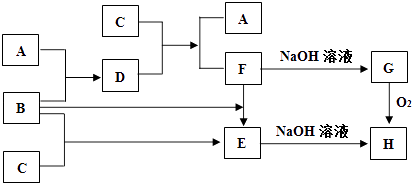
题目内容
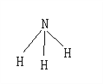
【题目】已知断裂1molH-H要吸收的能量为436kJ,形成1molH-N放出391kJ的能量,氨气的结构如图,根据化学方程式N2+3H2 ![]() 2NH3,1molN2与3molH2反应时放热92kJ,则断裂1molN≡N所需要的能量为 ( )
2NH3,1molN2与3molH2反应时放热92kJ,则断裂1molN≡N所需要的能量为 ( )
A. 431kJ B. 698kJ C. 946kJ D. 394kJ
【答案】C
【解析】已知:H-H键能为436kJ·mol-1,H-N键能为391kJ·mol-1,设N≡N的键能为x,对于反应N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ·mol-1,反应热=反应物的总键能-生成物的总键能,故x+3×436kJ·mol-1-2×3×391kJ·mol-1=-92.4kJ·mol-1,解得:x=945.6 kJ·mol-1,故选:C。
2NH3(g)△H=-92.4kJ·mol-1,反应热=反应物的总键能-生成物的总键能,故x+3×436kJ·mol-1-2×3×391kJ·mol-1=-92.4kJ·mol-1,解得:x=945.6 kJ·mol-1,故选:C。

【题目】现有部分元素的性质与原子(或分子)结构如下表所示:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 最高正价与最低负价的代数和为2,常温下单质为气体 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
(1)画出元素T的原子结构示意图:_________________。
(2)元素Y与Z相比金属性较强的是Y,下列不能证明这一事实的是____(填字母)。
a.Y的最外层电子数比Z少
b.Y单质与水反应比Z单质与水反应剧烈
c.Y最高价氧化物对应的水化物的碱性比Z的强
(3)写出X形成单质的电子式_________________。(用元素符号表示)
(4)T可以形成稳定的阴离子Tm-,Y可以形成稳定的阳离子Yn+,其半径关系为r(Tm-) ______ r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高价氧化物对应的水化物可以相互发生反应,写出Y、Z的最高价氧化物对应的水化物之间反应的离子方程式___________________________。