题目内容
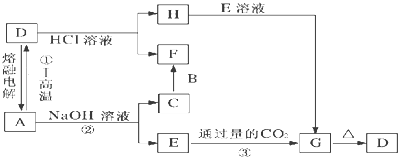
【题目】铁及其化合物在生产、生活中有着广泛的应用。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体,同时得到浅绿色酸性溶液。为此,他们设计了如下装置验证所产生的气体(夹持装置省略)并进行有关实验。

(1)①若装置A中的试管不加热,则没有明显现象,原因是____________。
②证明有SO2 生成的现象是_____;为了证明气体中含有氢气,装置B和C中加入的试剂分别为X、CuSO4,请写出装置B处反应的化学方程式________________。
(2)取装置A试管中的溶液6mL,加入适量氯水恰好反应,再加入过量的KI溶液后,分别取2mL此溶液于3支小试管中进行如下实验:
①第一支试管中加入1mLCCl4,充分振荡、静置,CCl4层呈紫色;
②第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有____(填离子符号),由此可以证明该离子与I-发生的氧化还原反应为_______。
(3)向盛有H202溶液的试管中加入几滴装置A试管中的溶液,溶液变成棕黄色,发生反应的离子方程式为_________________;一段时间后,溶液中有气泡出现并放热,随后有红褐色沉淀生成。产生气泡的原因是________________;生成沉淀的原因是_______________ (用平衡移动原理解释)。
【答案】 常温下,铁的表面被浓硫酸氧化为致密的氧化物薄膜,阻止了浓硫酸与内层的铁进一步反应 酸性高锰酸钾溶液褪色 CuO+H2![]() Cu+H2O Fe2+ Fe3+ 可逆反应 H2O2+2Fe2++2H+=2Fe3++2H2O 反应产生的Fe3+是H2O2分解的催化剂,使H2O2 分解产生O2 Fe3++3H2O
Cu+H2O Fe2+ Fe3+ 可逆反应 H2O2+2Fe2++2H+=2Fe3++2H2O 反应产生的Fe3+是H2O2分解的催化剂,使H2O2 分解产生O2 Fe3++3H2O![]() Fe(OH)3+3H+,反应消耗H+使c(H+)降低,且H2O2 分解反应放热,促使水解平衡正向移动,产生较多Fe(OH)3,聚集形成沉淀
Fe(OH)3+3H+,反应消耗H+使c(H+)降低,且H2O2 分解反应放热,促使水解平衡正向移动,产生较多Fe(OH)3,聚集形成沉淀
【解析】(1)①A为铁与浓硫酸反应装置,常温下,铁遇浓硫酸发生钝化,即:铁的表面被浓硫酸氧化为致密的氧化物薄膜,阻止了浓硫酸与内层的铁进一步反应,所以装置A中的试管不加热,则没有明显现象。②SO2具有还原性,能被酸性KMnO4溶液氧化,所以证明有SO2生成的现象是酸性高锰酸钾溶液褪色;由C中盛有硫酸铜,可判断出证明气体中含有氢气的方法是:装置B和C中加入的试剂分别为CuO、CuSO4,若含有H2,H2可把CuO还原为Cu,生成的H2O能与CuSO4反应生成蓝色的CuSO45H2O,B处反应化学方程式为:CuO+H2![]() Cu+H2O。
Cu+H2O。
(2)根据检验Fe2+方法,加入K3[Fe(CN)6],若产生蓝色沉淀则有Fe2+,故实验②检验的离子是:Fe2+;I2易溶于CCl4,在CCl4中呈紫色,实验①说明I-被氧化成I2,Fe3+遇KSCN溶液显红色,实验③说明在I-过量的情况下溶液中仍有Fe3+,所以由实验①和③可以证明Fe3+与I-发生了氧化还原反应,但并没有反应完全,存在反应限度,因此该氧化还原反应为可逆反应。
(3)A试管中的溶液含有Fe2+,向盛有H202溶液的试管中加入几滴装置A试管中的溶液,发生氧化还原反应生成Fe3+,Fe3+的溶液呈棕黄色,反应的离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O;生成的Fe3+对双氧水起催化作用,双氧水分解产生氧气并放热,促进了Fe3+水解平衡正向移动,产生Fe(OH)3沉淀,所以一段时间后,溶液中有气泡出现并放热,随后有红褐色沉淀生成。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案