��Ŀ����
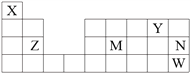
����Ŀ���������п�ͼ��ϵ��գ���֪��Ӧ�١������ҹ���ҵ�����е���Ҫ��Ӧ��X������Ϊ��ɫ��ζ��Һ�壻C��ɫ��Ӧ����ʻ�ɫ��JΪ���ɫ������D��E������Ϊ���壬��E��ʹƷ����Һ��ɫ��A�����н�������Ԫ�أ����н���Ԫ�ص���������ԼΪ46.7%�� 
��1��A�Ļ�ѧʽΪ�� F�Ļ�ѧʽΪ��
��2����Ӧ�۵Ļ�ѧ����ʽ����
��3����Ӧ�ڵ����ӷ���ʽ����
��4����Ӧ�ܵ����ӷ���ʽ����
��5����֪ÿ����16g E���ų�106.5kJ��������Ӧ�ٵ��Ȼ�ѧ����ʽΪ�� ��
���𰸡�
��1��FeS2��Fe2O3
��2��2SO2+O2 ![]() 2SO3
2SO3
��3��2Na2O2+2H2O�T4Na++4OH��+O2��
��4��Fe2O3+6H+�T2Fe3++3H2O
��5��FeS2��s��+ ![]() O2��g���T
O2��g���T ![]() Fe2O3��s��+2SO2��g����H=��852 kJ/mol
Fe2O3��s��+2SO2��g����H=��852 kJ/mol
���������⣺�������п�ͼ��ϵ��գ���֪��Ӧ�١������ҹ���ҵ�����е���Ҫ��Ӧ��X������Ϊ��ɫ��ζ��Һ���ƶ�Ϊˮ��C��ɫ��Ӧ����ʻ�ɫ˵������Ԫ�أ�JΪ���ɫ����Ϊ����������FΪFe2O3��D��E������Ϊ���壬��E��ʹƷ����Һ��ɫ˵��EΪSO2��GΪSO3��HΪH2SO4��IΪ��������˼· 1��3������Ӧ����D����1�Ǹ��������·�Ӧ�ģ���������DΪ������������Ӧ��������BΪ�������ƣ�CΪ�������ƣ�DΪ������A��D�ڸ����·�Ӧ���ɶ�������ͺ��������Ļ������ҵ�ϳ��õ������������е���Ҫ��Ӧ������Ĺ�ҵ����������Ĺ�ҵ����������Ĺ�ҵ����ԭ�϶�Ϊ������ͻ��������������ǻ���������AΪFeS2����AΪFeS2����BΪNa2O2��CΪNaOH��xΪH2O����DΪ������EΪSO2��FΪFe2O3 �� GΪSO3��HΪ���ᣬIΪ��������JΪ������������1�����ݷ����жϽ����AΪ��FeS2 �� FΪ Fe2O3 �� ���Դ��ǣ�FeS2��Fe2O3����2����Ӧ���Ƕ�������������ķ�Ӧ����Ӧ����ʽΪ2SO2+O2 ![]() 2 SO3�����Դ��ǣ�2SO2+O2
2 SO3�����Դ��ǣ�2SO2+O2 ![]() 2 SO3����3����Ӧ���ǹ���������ˮ��Ӧ����Ӧ�����ӷ���ʽΪ��2Na2O2+2H2O=4Na++4OH��+O2�������Դ��ǣ�2Na2O2+2H2O=4Na++4OH��+O2������4����Ӧ�������������������ᷴӦ����Ӧ�����ӷ���ʽΪ��Fe2O3+6H+=2Fe3++3H2O����5����֪ÿ����16g EΪSO2 �� ���ʵ���Ϊ0.25mol���ų�106.5kJ���������ݻ�ѧ����ʽ4FeS2��s��+11O2��g��=2Fe2O3��s��+8SO2��g��������8molSO2 �� ����Ϊ��
2 SO3����3����Ӧ���ǹ���������ˮ��Ӧ����Ӧ�����ӷ���ʽΪ��2Na2O2+2H2O=4Na++4OH��+O2�������Դ��ǣ�2Na2O2+2H2O=4Na++4OH��+O2������4����Ӧ�������������������ᷴӦ����Ӧ�����ӷ���ʽΪ��Fe2O3+6H+=2Fe3++3H2O����5����֪ÿ����16g EΪSO2 �� ���ʵ���Ϊ0.25mol���ų�106.5kJ���������ݻ�ѧ����ʽ4FeS2��s��+11O2��g��=2Fe2O3��s��+8SO2��g��������8molSO2 �� ����Ϊ�� ![]() =3408KJ����Ӧ���Ƕ���������������Ӧ���������������Ͷ�������Ӧ���Ȼ�ѧ����ʽΪ��4FeS2��s��+11O2��g��=2Fe2O3��s��+8SO2��g������H=��3408 kJ/mol��FeS2��s��+
=3408KJ����Ӧ���Ƕ���������������Ӧ���������������Ͷ�������Ӧ���Ȼ�ѧ����ʽΪ��4FeS2��s��+11O2��g��=2Fe2O3��s��+8SO2��g������H=��3408 kJ/mol��FeS2��s��+ ![]() O2��g���T
O2��g���T ![]() Fe2O3��s��+2SO2��g����H=��852 kJ/mol�����Դ��ǣ�FeS2��s��+
Fe2O3��s��+2SO2��g����H=��852 kJ/mol�����Դ��ǣ�FeS2��s��+ ![]() O2��g���T
O2��g���T ![]() Fe2O3��s��+2SO2��g����H=��852 kJ/mol��
Fe2O3��s��+2SO2��g����H=��852 kJ/mol��