��Ŀ����
����Ŀ�������йط�Ӧ���ʵ�˵����ȷ���ǣ�
A. ����Ƭ��ϡ���ᷴӦ������ʱ������98%��������Լӿ췴Ӧ����
B. 100 mL 2 molL��1�������пƬ��Ӧ�������������Ȼ�����Һ����Ӧ���ʲ���
C. ��ӦC(s)��H2O(g) ![]() CO(g)��H2(g)��һ�ɱ��ݻ����ܱ������н��У�����C���� , �䷴Ӧ��������
CO(g)��H2(g)��һ�ɱ��ݻ����ܱ������н��У�����C���� , �䷴Ӧ��������
D. ����β���е�NO��CO���Ի�����Ӧ����N2��CO2����Сѹǿ��Ӧ���ʱ���:
���𰸡�D
��������A������Ũ���ᷴӦ���������γ�һ�����ܵ������ﱣ��Ĥ����ֹŨ�������������Ӧ������Ũ����ܼӿ췴Ӧ���ʣ�A����B�������Ȼ�����Һ����Һ�������������Ũ�ȼ�С����Ӧ���ʼ�С��B����C��̼�ǹ��壬���ӹ����������Ӧ���ʲ��䣬C����B����Сѹǿ����Ӧ���ʼ�С��D��ȷ����ѡD��

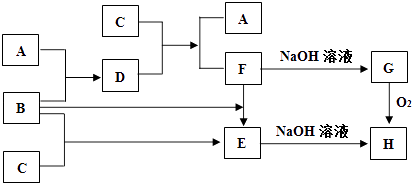
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ������ΪԪ�����ڱ���һ���֡�
̼ | �� | Y | |
X | �� | Z |
������֪Ԫ��C��N��S��δ֪��Ԫ��X��Y��Z���ش��������⣺
��1��ZԪ�������ڱ��е�λ��Ϊ______________��
��2������Ԫ��ԭ�Ӱ뾶������______________ (дԪ�ط���)��
��3����S��Z���γɻ�����S2Z2��д�����ĵ���ʽ______________��
��C��N��S��Ԫ���γɵ������ӳ����ڼ���Fe3+�Ĵ��ڣ�д�����Ľṹʽ______________��
��4��ͭ��һ��Ũ�ȵ����������Ļ���ᷴӦ�����ɵ���ֻ������ͭ��ͬʱ���ɵ���������A��B���ɱ�������Ԫ����ɣ��������Է���������С��50��Ϊ��ֹ��Ⱦ����������������ȫת��Ϊ��ۺ������Σ�����1L2.2mol��L-1NaOH��Һ��1molO2������������ķ���ʽ�����ʵ����ֱ�Ϊ______________����������ͭ���ʵ���Ϊ______________��