题目内容
【题目】某小组通过分析镁与酸反应时pH的变化,探究镁与醋酸溶液反应的实质。
(实验)在常温水浴条件下,进行实验Ⅰ~Ⅲ,记录生成气体体积和溶液pH的变化:
Ⅰ.取0.1 g光亮的镁屑(过量)放入10 mL 0.10 mol·L–1 HCl溶液中;
Ⅱ.取0.1 g光亮的镁屑放入10 mL 0.10 mol·L–1 CH3COOH溶液(pH = 2.9)中;
Ⅲ.取0.1 g光亮的镁屑放入10 mL pH = 2.9 HCl溶液中。
(数据)
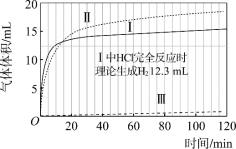
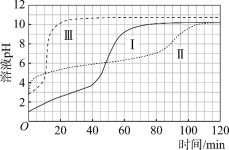
图1 图2
(1)起始阶段,Ⅰ中主要反应的离子方程式是____。
(2)Ⅱ起始溶液中![]() 约为____。(选填“1”、“10”或“102”)
约为____。(选填“1”、“10”或“102”)
(3)起始阶段,导致Ⅱ、Ⅲ气体产生速率差异的主要因素不是c(H+),实验证据是____。
(4)探究Ⅱ的反应速率大于Ⅲ的原因。
提出假设:CH3COOH能直接与Mg反应。
进行实验Ⅳ:____。
得出结论:该假设成立。
(5)探究醋酸溶液中与Mg反应的主要微粒,进行实验Ⅴ。
与Ⅱ相同的条件和试剂用量,将溶液换成含0.10 mol·L–1的 CH3COOH与0.10 mol·L–1 CH3COONa的混合溶液(pH = 4.8),气体产生速率与Ⅱ对比如下。
a.实验Ⅴ起始速率 | b.实验Ⅱ起始速率 | c.实验ⅡpH=4.8时速率 |
2.1 mL·min–1 | 2.3 mL·min–1 | 0.8 mL·min–1 |
对比a~c中的微粒浓度,解释其a与b、a与c气体产生速率差异的原因:____。
(6)综合以上实验得出结论:
①镁与醋酸溶液反应时,CH3COOH、H+、H2O均能与镁反应产生氢气;
②____。
(7)实验反思:120 min附近,Ⅰ~ⅢpH均基本不变,pH(Ⅰ) ≈ pH(Ⅱ) < pH(Ⅲ),解释其原因:____。
【答案】Mg + 2H+ = Mg2+ + H2↑ 102 由图1可知起始阶段Ⅱ的速率远大于Ⅲ,但图2表明起始阶段Ⅱ的pH大于Ⅲ 室温下,将光亮的镁屑投入冰醋酸中,立即产生气体 a与b对比,c(CH3COOH)几乎相同,但b中c(H+) 约为a的100倍,使速率b > a;a与c对比,c(H+)几乎相同,但a中c(CH3COOH)约为c 的2倍,使速率a > c CH3COOH是与Mg反应产生气体的主要微粒 120min附近,Mg(OH)2(s) Mg2+(aq) + 2OH–(aq)均达到平衡状态,因此pH基本不变;c(Mg2+) Ⅰ≈Ⅱ>Ⅲ,Ⅰ、Ⅱ中上述平衡相对Ⅲ逆移,c(OH–)减小,pH减小
【解析】
反应刚开始时,由于 Ⅰ 中c(H+)最大,所以反应速率最快,消耗n(H+)最多,但如果只发生反应2H++Mg=Mg2++H2↑,则Ⅰ、Ⅱ中产生H2的体积应相差较大,但实际上体积相差不大,说明醋酸也能与镁直接反应;从Ⅱ、Ⅲ中产生H2的体积也可得出同样的结论。当Ⅰ、Ⅱ中产生H2的体积相同时,盐酸、醋酸应完全反应,但产生H2的体积继续增大,表明Mg与H2O能发生反应Mg+2H2O= Mg(OH)2+ H2↑,且醋酸中产生的H2更多,说明Mg与H2O反应的速率Ⅱ中更快。比较Ⅱ、Ⅲ中溶液的pH,随着反应的进行,Ⅱ的pH比Ⅲ大,但产生H2的速率Ⅱ>Ⅲ,表明c(H+)不是影响反应速率的唯一因素;比较Ⅰ、Ⅱ溶液的pH,当pH相等后,盐酸中溶液的pH先趋于稳定,说明盐酸与Mg反应先结束,而醋酸与Mg反应后结束;Ⅲ与Ⅰ、Ⅱ溶液进行比较,Ⅲ的pH大,则表明Ⅲ中c(OH–)大,应为Ⅰ、Ⅱ溶液中c(Mg2+)引起。
(1)起始阶段,Ⅰ 中主要发生镁与盐酸的反应,离子方程式是Mg + 2H+= Mg2++ H2↑。答案为:Mg + 2H+= Mg2++ H2↑;
(2)Ⅱ 起始溶液中![]() 约为
约为![]() =102。答案为:102;
=102。答案为:102;
(3)起始阶段,虽然Ⅱ、Ⅲ中c(H+)相等,但从产生H2的体积判断,Ⅱ、Ⅲ中气体产生速率差异很大,而Ⅱ的pH大于Ⅲ,则表明主要因素不是c(H+),实验证据是:由图1可知,起始阶段Ⅱ的速率远大于Ⅲ,但图2表明起始阶段Ⅱ的pH大于Ⅲ。答案为:由图1可知,起始阶段Ⅱ的速率远大于Ⅲ,但图2表明起始阶段Ⅱ的pH大于Ⅲ;
(4)既然c(H+)不是影响反应速率的主要原因,那么有可能是醋酸能与Mg直接反应,于是进行实验Ⅳ:室温下,将光亮的镁屑投入冰醋酸中,立即产生气体。答案为:室温下,将光亮的镁屑投入冰醋酸中,立即产生气体;
(5) a与b中醋酸浓度相同、但a中c(H+)小,反应速率慢;a与c中,c(H+)相同,但醋酸浓度c大约是a中的一半(假设实验Ⅱ中醋酸反应掉近一半,此时溶液中醋酸与醋酸根离子浓度相等,刚好为a中的一半,pH比a中稍大),反应速率慢,由此得出气体产生速率差异的原因:a与b对比,c(CH3COOH)几乎相同,但b中c(H+)约为a的100倍,使速率b > a;a与c对比,c(H+)几乎相同,但a中c(CH3COOH)约为c 的2倍,使速率a > c。答案为:a与b对比,c(CH3COOH)几乎相同,但b中c(H+)约为a的100倍,使速率b > a;a与c对比,c(H+)几乎相同,但a中c(CH3COOH)约为c 的2倍,使速率a > c;
(6)①镁与醋酸溶液反应时,
②从实验Ⅰ、Ⅱ的比较中可得出,CH3COOH是与Mg反应产生气体的主要微粒。答案为:CH3COOH是与Mg反应产生气体的主要微粒;
(7) 120 min附近,Ⅰ~Ⅲ pH均基本不变、c(Mg2+)相同,而Ⅲ的pH大,c(Mg2+)小,所以解释pH(Ⅰ) ≈ pH(Ⅱ) < pH(Ⅲ)的原因,应为:120min附近,Mg(OH)2(s)Mg2+(aq) + 2OH–(aq)均达到平衡状态,因此pH基本不变;c(Mg2+) Ⅰ≈Ⅱ>Ⅲ,Ⅰ、Ⅱ中上述平衡相对Ⅲ逆移,c(OH–)减小,pH减小。答案为:120min附近,Mg(OH)2(s)Mg2+(aq) + 2OH–(aq)均达到平衡状态,因此pH基本不变;c(Mg2+) Ⅰ≈Ⅱ>Ⅲ,Ⅰ、Ⅱ中上述平衡相对Ⅲ逆移,c(OH–)减小,pH减小。