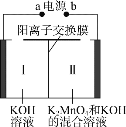
题目内容
【题目】(1)珊瑚礁是珊瑚虫吸收海水中的钙和二氧化碳,然后分泌出石灰石,经过以后的压实、石化形成的礁石。珊瑚礁的主要成分是________(填化学式),近年来珊瑚礁受海水侵蚀,退化严重,请写出海水侵蚀珊瑚礁的化学方程式:_____________________。
(2)下图为一定量饱和Ca(OH)2溶液中通入CO2气体后,产生CaCO3白色沉淀的质量与通入的CO2体积之间的关系曲线。请回答:
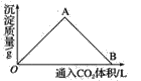
①OA段曲线所表示的化学反应方程式:_____________,A点处已参加反应的CO2与Ca(OH)2的物质的量之比为________。
②B处溶液中存在的浓度较大的两种离子是________和________(填离子符号),将B处生成的溶液煮沸,可见到的现象是_______________________。
【答案】CaCO3 CaCO3+H2O+CO2===Ca(HCO3)2 Ca(OH)2+CO2===CaCO3↓+H2O 1:1 Ca2+ HCO3- 溶液变浑浊(或产生白色沉淀),同时有气泡产生
【解析】
(1)由前面陈述,可清楚珊瑚礁的主要成分。近年来发现珊瑚礁受海水侵蚀,退化严重,则发生碳酸钙转化为碳酸氢钙的反应。
(2)①向饱和Ca(OH)2溶液中通入CO2气体,则生成CaCO3,通过书写化学方程式,可得出A点处已参加反应的CO2与Ca(OH)2的物质的量之比。
②继续通入CO2气体会使白色沉淀CaCO3转化为易溶于水的Ca(HCO3)2,则Ca(HCO3)2的电离方程式,可得出溶液中浓度较大的离子;将B处的溶液煮沸时,发生Ca(HCO3)2的分解反应。
(1)珊瑚虫分泌出石灰石形成珊瑚礁,珊瑚礁的主要成分是CaCO3。近年来珊瑚礁受海水侵蚀,退化严重,发生反应的化学方程式:CaCO3+H2O+CO2==Ca(HCO3)2。答案为:CaCO3;CaCO3+H2O+CO2==Ca(HCO3)2;
(2) ①向饱和Ca(OH)2溶液中通入CO2气体一开始会产生白色沉淀,直到Ca(OH)2被完全反应后,白色沉淀量达到最大值,因此OA段的化学方程式为Ca(OH)2+CO2==CaCO3↓+H2O ,A点处已参加反应的CO2与Ca(OH)2的物质的量之比为1∶1;答案为:Ca(OH)2+CO2==CaCO3↓+H2O;1:1;
②继续通入CO2气体会使白色沉淀CaCO3转化为易溶于水的Ca(HCO3)2,白色沉淀消失,因此AB段的化学方程式为CaCO3+CO2+H2O==Ca(HCO3)2;B处为碳酸氢钙溶液,溶液中浓度较大的离子为Ca2+和HCO![]() ,将B处的溶液煮沸时发生反应Ca(HCO3)2
,将B处的溶液煮沸时发生反应Ca(HCO3)2![]() CaCO3↓+H2O+CO2↑。答案为:Ca2+;HCO3-;溶液变浑浊(或产生白色沉淀),同时有气泡产生。
CaCO3↓+H2O+CO2↑。答案为:Ca2+;HCO3-;溶液变浑浊(或产生白色沉淀),同时有气泡产生。

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】某小组通过分析镁与酸反应时pH的变化,探究镁与醋酸溶液反应的实质。
(实验)在常温水浴条件下,进行实验Ⅰ~Ⅲ,记录生成气体体积和溶液pH的变化:
Ⅰ.取0.1 g光亮的镁屑(过量)放入10 mL 0.10 mol·L–1 HCl溶液中;
Ⅱ.取0.1 g光亮的镁屑放入10 mL 0.10 mol·L–1 CH3COOH溶液(pH = 2.9)中;
Ⅲ.取0.1 g光亮的镁屑放入10 mL pH = 2.9 HCl溶液中。
(数据)
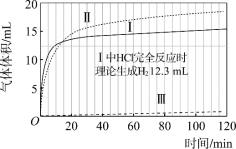
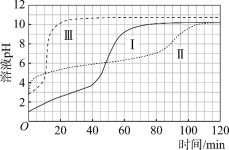
图1 图2
(1)起始阶段,Ⅰ中主要反应的离子方程式是____。
(2)Ⅱ起始溶液中![]() 约为____。(选填“1”、“10”或“102”)
约为____。(选填“1”、“10”或“102”)
(3)起始阶段,导致Ⅱ、Ⅲ气体产生速率差异的主要因素不是c(H+),实验证据是____。
(4)探究Ⅱ的反应速率大于Ⅲ的原因。
提出假设:CH3COOH能直接与Mg反应。
进行实验Ⅳ:____。
得出结论:该假设成立。
(5)探究醋酸溶液中与Mg反应的主要微粒,进行实验Ⅴ。
与Ⅱ相同的条件和试剂用量,将溶液换成含0.10 mol·L–1的 CH3COOH与0.10 mol·L–1 CH3COONa的混合溶液(pH = 4.8),气体产生速率与Ⅱ对比如下。
a.实验Ⅴ起始速率 | b.实验Ⅱ起始速率 | c.实验ⅡpH=4.8时速率 |
2.1 mL·min–1 | 2.3 mL·min–1 | 0.8 mL·min–1 |
对比a~c中的微粒浓度,解释其a与b、a与c气体产生速率差异的原因:____。
(6)综合以上实验得出结论:
①镁与醋酸溶液反应时,CH3COOH、H+、H2O均能与镁反应产生氢气;
②____。
(7)实验反思:120 min附近,Ⅰ~ⅢpH均基本不变,pH(Ⅰ) ≈ pH(Ⅱ) < pH(Ⅲ),解释其原因:____。