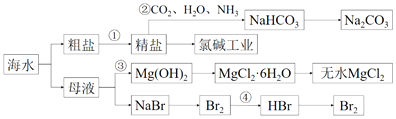
题目内容
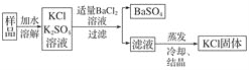
【题目】实验室需要制备纯净的氯化钾。现含有少量K2SO4的氯化钾样品,按照如图所示的实验方案进行提纯。
(1)检验加入BaCl2溶液后![]() 是否沉淀完全的操作为____________________________。
是否沉淀完全的操作为____________________________。
(2)若用硝酸钡来代替氯化钡,请判断是否可行,并说明理由:_____________________。
(3)某同学认为该实验方案中加适量氯化钡溶液不容易控制,应加入过量氯化钡溶液,他的思路如下:

请写出①②③④⑤溶质或沉淀的化学式:______________________。
【答案】静置一段时间后,取少量上层澄清溶液于试管中,再滴加BaCl2溶液,若无沉淀生成,则![]() 沉淀完全,反之
沉淀完全,反之![]() 未沉淀完全不可行,会引入
未沉淀完全不可行,会引入![]() 杂质①KCl、BaCl2 ②K2CO3 ③BaCO3 ④KCl、K2CO3 ⑤HCl
杂质①KCl、BaCl2 ②K2CO3 ③BaCO3 ④KCl、K2CO3 ⑤HCl
【解析】
(1)加入氯化钡是为了沉淀硫酸根离子,所以检验硫酸根离子是否完全沉淀的方法为:静置一段时间后,取少量上层澄清溶液于试管中,再滴加BaCl2溶液,若无沉淀生成,则![]() 沉淀完全,反之
沉淀完全,反之![]() 未沉淀完全;(2)加入硝酸钡会引入
未沉淀完全;(2)加入硝酸钡会引入![]() 杂质,所以不可行。(3). 在氯化钾和硫酸钾溶液中加入过量的氯化钡溶液,得到硫酸钡沉淀和滤液①,滤液①含有氯化钾和氯化钡,滤液中加入过量的碳酸钾沉淀钡离子,得到沉淀为碳酸钡,滤液含有氯化钾和碳酸钾,在加入过量的盐酸,得到氯化钾溶液,蒸发冷却结晶得到氯化钾固体。所以答案为:①KCl、BaCl2 ②K2CO3 ③BaCO3 ④KCl、K2CO3 ⑤HCl。
杂质,所以不可行。(3). 在氯化钾和硫酸钾溶液中加入过量的氯化钡溶液,得到硫酸钡沉淀和滤液①,滤液①含有氯化钾和氯化钡,滤液中加入过量的碳酸钾沉淀钡离子,得到沉淀为碳酸钡,滤液含有氯化钾和碳酸钾,在加入过量的盐酸,得到氯化钾溶液,蒸发冷却结晶得到氯化钾固体。所以答案为:①KCl、BaCl2 ②K2CO3 ③BaCO3 ④KCl、K2CO3 ⑤HCl。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】过氧化尿素是一种新型漂白剂、消毒剂、漂白、消毒的效果优于H2O2和过氧乙酸。某工业用过氧化尿素的部分参数见下表:
分子式 | 外观 | 热分解温度 | 熔点 | 水溶性(20℃) |
CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 500g·L-1 |
合成过氧化尿素的步骤及反应器的示意图如下:在250mL三颈烧瓶中加入一定量的30%的H2O2溶液,再加入30g尿素,在不断搅拌下升温至300℃,使尿素完全溶解,保温30min,冷却至-5℃进行结晶。抽滤得白色粉末状结晶。在50℃下干燥2h,得过氧化尿素产品。回答下列问题:
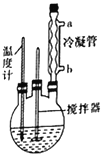
(1)控制反应温度的适宜方法是__________ (填序号)。
A.酒精灯加热 B.酒精喷灯加热 C.电炉加热 D.水浴加热
(2)反应器中发生反应的化学方程式为___________________________________。
(3)反应器中冷凝管中冷水从______(填“a”或“b”)流进;反应器加热温度不能太高的原因是___________。
(4)搅拌器不能选择铁质或铝质材料的原因是_______________________________________。
(5)为测定产品中活性氧的含量(活性氧16%,相当于含H2O234%),称取干燥样品12.000g,溶解,在250mL 容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL6mol·L-1的硫酸,然后用0.2000mol·L-1KMnO4标准溶液滴定(KMnO4溶液与尿素不反应),平行实验三次,实验结果如下:
实验序号 | 1 | 2 | 3 | |
KMnO4溶液体积/mL | 滴定前读数 | 0.00 | 0.00 | 2.00 |
滴定后读数 | 19.98 | 21.70 | 22.02 | |
①KMnO4溶液应盛放在__________滴定管中,滴定终点的现象是_____________。
②产品中活性氧的质量分数为____________。
③若滴定前滴定管尖嘴处无气泡,滴定后有气泡,会使测得的活性氧含量__________(填“偏高”“偏低”或“不变”)。