题目内容
6.甲、乙、丙三位同学在实验室用不同方法制取氮气.(1)甲同学让空气通过图1所示装置,以除去氧气制得氮气.硬质玻璃管中所盛固体可选用A(填下列选项标号)
A.铁粉 B.碳粉 C.过氧化钠 D.碱石灰
(2)收集氮气可选用C(填图2选项标号)

(3)乙同学设计用氨气和炽热的氧化铜反应制取氮气,反应方程式为2NH3+3CuO $\frac{\underline{\;\;△\;\;}}{\;}$ N2+3Cu+3H2O.
(4)制取氨气可选用AC(填下列选项标号)
A.加热硫酸铵与氢氧化钙混合物
B.加热分解氯化铵晶体
C.浓氨水滴入氢氧化钠固体
D.加热浓氨水使氨气化
(5)丙同学用加热两种含氮溶液制氮气:NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O.该实验装置需要烧瓶、分液漏斗、酒精灯等玻璃仪器.
(6)氮气助燃金属镁,反应方程式:3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;燃烧3.6g镁将消耗标准状况下氮气1120mL.
分析 (1)铁粉与碳粉均可于氧气反应,C与氧气反应生成另外的气体,据此解答;
(2)氮气不溶于水,且密度与空气相近,故可以利用排水法收集;
(3)氨气与氧化铜反应生成氮气、铜和水,据此书写化学反应方程式;
(4)制取氨气可以利用固体固体加热方法、可以利用液体+固体加热方法等;
(5)液体与液体加热制取气体利用烧瓶;
(6)氮气与镁反应生成氮化镁,依据氧化还原反应得失电子守恒计算生成的氨气体积.
解答 解:(1)A、铁粉可以与空气中的氧气反应生成固体四氧化三铁,故正确;
B、碳粉可于氧气反应,但是生成气体为二氧化碳或者CO,不能得到纯净的氮气,故错误;
C、过氧化钠与氧气不反应,故错误;
D、碱石灰与氧气不反应,故错误,
故选A;
(2)氮气不溶于水,且密度与空气相近,故可以利用排水法收集,故选C;
(3)氨气与氧化铜反应生成氮气、铜和水,化学反应方程式为:2NH3+3CuO $\frac{\underline{\;\;△\;\;}}{\;}$ N2+3Cu+3H2O,故答案为:2NH3+3CuO $\frac{\underline{\;\;△\;\;}}{\;}$ N2+3Cu+3H2O;
(4)制取氨气可以利用固体固体加热方法、可以利用液体+固体加热方法等,
A.加热硫酸铵与氢氧化钙混合物,生成氨气和硫酸钙,能得到氨气,故A正确;
B.加热分解氯化铵晶体,得到氨气和HCl气体,受冷重新凝结为氯化铵,不能得到氨气,故B错误;
C.浓氨水滴入氢氧化钠固体,氢氧化钠固体溶于水放出大量的热,促进氨气的逸出,故C正确;
D.加热浓氨水使氨气化的同时,会逸出部分水蒸气,不能得到纯净的氨气,故D错误,
故选AC;
(5)液体与液体加热制取气体利用烧瓶,故答案为:烧瓶;
(6)氮气与镁反应生成氮化镁,化学反应方程式为:3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2,
72g 22.4L
3.6g x
解x=1.12L=1120mL,故答案为:3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;1120.
点评 本题主要考查的是空气中氮气的制取方法、气体收集仪器的选择、实验室制取氨气的方法,氧化还原反应有关物质的量的计算等,难度不大.

| A. | 向FeCl3溶液中滴加HI溶液:Fe3++2I-═Fe2++I2 | |
| B. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O═Al${{O}_{2}}^{-}$+4N${{H}_{4}}^{+}$+2H2O | |
| C. | 向稀NH4HCO3溶液中加入过量NaOH溶液:N${{H}_{4}}^{+}$+OH-═NH3•H2O | |
| D. | 向苯酚钠溶液中通入少量CO2: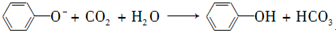 - - |
| A | A的一种单质在自然界中硬度最大 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | 同周期中,C元素的最高价氧化物对应的水化物的碱性最强 |
| D | D的基态原子M层电子数是K层的2 倍 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
(2)A、B、D三种元素电负性由大到小排列顺序为N>C>Si
(3)A和B的最简单氢化物中沸点较高的NH3.原因是NH3分子间存在氢键.
(4)已知:
①AH4(g)+2BO2(g)-B2(g)+AO2(g)+2H2O(g) H1=-867kJ•mol-1
②2BO2(g)-B2 O4(g) H2=-56.9kJ•mol-1
写出AH4和B2O4反应的热化学方程式CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(g)△H=-810.1kJ/mol.
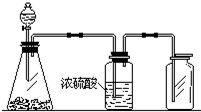 如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )| A. | 碳酸钙和稀盐酸 | B. | 二氧化锰和浓盐酸 | ||
| C. | 锌粒和稀硫酸 | D. | 碱石灰和浓氨水 |
| A. | W的最高价氧化物和SiO2都是两性氧化物 | |
| B. | 只含X、Y、Z三种元素的某水溶液一定呈酸性 | |
| C. | 由X、M与Z形成的化合物X2Z2和M2Z2中所含的化学键类型相同 | |
| D. | M的单质可用于从钛、锆等金属的氯化物中制备钛、锆等单质 |
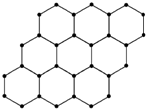
| A. | 石墨烯与石墨互称为同位素 | |
| B. | 12 g石墨烯中约含有6.02×1023个电子 | |
| C. | 石墨烯中可能含有离子键 | |
| D. | 石墨烯中的碳原子间以共价键相结合 |
| 选项 | 实验目的 | 仪器 |
| A | 用溴水和CCl4除去NaBr溶液中少量NaI | 烧杯、玻璃棒、胶头滴管、分液漏斗 |
| B | 配制100mL l.0mol•L-1的NaOH溶液 | 药匙、天平、量筒、烧杯、玻璃棒、胶头滴管、100mL的容量瓶 |
| C | 从食盐水中获得NaCl晶体 | 酒精灯、玻璃棒、坩埚、泥三角 |
| D | 用盐酸除去BaSO4中混有的少量BaCO3 | 漏斗,烧杯、玻璃棒、胶头滴管、滤纸 |
| A. | A | B. | B | C. | C | D. | D |