题目内容
【题目】已知下列反应的能量变化示意图如下,有关说法正确的是( )
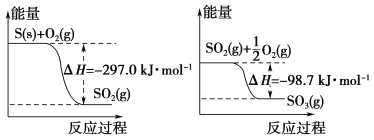
A. 1 mol S(g)与O2(g)完全反应生成SO2(g),反应放出的热量小于297.0 kJ
B. 在相同条件下,SO2(g)比SO3(g)稳定
C. S(s)与O2(g)反应生成SO3(g)的热化学方程式S(s)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=+395.7 kJ·mol-1
SO3(g) ΔH=+395.7 kJ·mol-1
D. 一定条件下1 mol SO2(g)和![]() mol O2(g)反应,生成1 mol SO3(l)放出热量大于98.7 kJ
mol O2(g)反应,生成1 mol SO3(l)放出热量大于98.7 kJ
【答案】D
【解析】
试题A、相同量的 S(g)的能量大于S(s)的能量,所以1mol S(g)与O2(g)完全反应生成SO2(g),反应放出的热量>297.0kJ/mol,故A错误;B、能量越高越不稳定,由图象可知SO2(g)的能量大于SO3(g),所以SO3(g)比SO2(g)稳定,故B错误;C、已知 S(s)+O2(g)=SO2(g)△H=-297.07kJ/mol,SO2(g)+![]() O2(g)=SO3(g)△H=-98.7kJ/mol,把两个方程相加得到 S(s)+
O2(g)=SO3(g)△H=-98.7kJ/mol,把两个方程相加得到 S(s)+![]() O2(g)
O2(g)![]() SO3(g)△H=-395.7kJ/mol,故C错误;D、依据图象分析可知反应放热,所以1mol SO2(g)和
SO3(g)△H=-395.7kJ/mol,故C错误;D、依据图象分析可知反应放热,所以1mol SO2(g)和![]() mol O2(g)生成1mol SO3(g)放出98.7kJ/mol,生成1 mol SO3(l)放出热量大于98.7 kJ,故D正确;故选D。
mol O2(g)生成1mol SO3(g)放出98.7kJ/mol,生成1 mol SO3(l)放出热量大于98.7 kJ,故D正确;故选D。

练习册系列答案
相关题目