题目内容
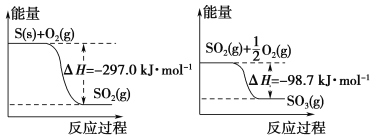
【题目】Na2O2可用作漂白剂和呼吸面具中的供氧剂。
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞试液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①使酚酞试液变红是因为____________________________________,红色褪去的可能原因是____________________________________________。
②加入MnO2反应的化学方程式为_______________________________。
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
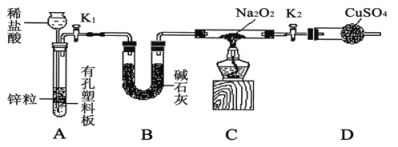
步骤1:按如图组装仪器(图中夹持仪器省略),检查气密性,装入药品;
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象;
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色;
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①盛装稀盐酸的仪器名称___________;B装置的作用是______________。
②必须检验氢气纯度的原因是_________________。
③设置装置D的目的是___________________________。
【答案】生成了碱性的NaOH 酚酞遇碱变红 生成的H2O2有漂白性 2H2O2![]() 2H2O+O2↑ 长颈漏斗 吸水 防止发生爆炸③检验反应中是否有水生成
2H2O+O2↑ 长颈漏斗 吸水 防止发生爆炸③检验反应中是否有水生成
【解析】
过氧化钠和水反应生成氢氧化钠和氧气,在实验中检验氢气是否和过氧化钠反应,可以用干燥的氢气和过氧化钠反应,看是否有水生成。碱石灰能吸收氢气中的水,硫酸铜能检验产物是否有水。
(1) ①酚酞遇碱变红,所以溶液变红,说明生成了碱性的NaOH;一位过氧化钠和水反应生成过氧化氢和氢氧化钠,生成的H2O2有漂白性,所以红色褪色;
②加入二氧化锰过氧化氢分解生成水和氧气,方程式为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2) ①盛装稀盐酸的仪器名称长颈漏斗 ;碱石灰可以吸收氢气中的水蒸气;
②因为氢气是易燃气体,所以点燃前必须检验氢气的纯度,防止发生爆炸;
③硫酸铜遇水变蓝,所以可以检验反应中是否有水生成。

【题目】用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
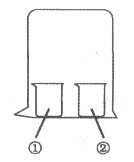
①中的物质 | ②中的物质 | 预测①的现象 | |
A | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
B | 酚酞溶液 | 浓盐酸 | 无明显变化 |
C | MgCl2溶液 | 浓氨水 | 有白色沉淀 |
D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
A. AB. BC. CD. D